特瑞普利单抗获批黑色素瘤一线治疗,为全人群提供系统化解决方案
特瑞普利单抗注射液(拓益)用于不可切除或转移性黑色素瘤的一线治疗的新适应症上市申请于近日获得国家药品监督管理局(NMPA)批准。
2025-04-26强生宣布锐珂(埃万妥单抗注射液)联合化疗方案在华获批用于EGFR TKI经治后局部晚期或转移性非小细胞肺癌患者治疗
MARIPOSA-2 III期研究显示,埃万妥单抗联合化疗与单独化疗组相比中位PFS显著获益,可将疾病进展或死亡风险降低52%。其中亚洲亚组数据表明亚洲人群研究者评估中位PFS为10.3个月 。
2025-04-25荃科得联合氟维司群在华获批用于HR阳性晚期乳腺癌患者
首个且唯一在华获批、用于特定生物标志物(PIK3CA、AKT1 或 PTEN)改变的乳腺癌患者的AKT抑制剂。
2025-04-25伟立瑞在华获批用于治疗成人全身型重症肌无力患者
长效C5补体抑制剂通过每八周一次的给药方式,可改善患者的生活质量,帮助减轻治疗负担伟立瑞首次在华获批,助力全球罕见病患者提升创新药物可及
2025-04-22千亿GLP-1市场再添重磅产品!华东医药司美格鲁肽注射液国内上市申请获受理
本次申报适应症为成人2型糖尿病患者的血糖控制。
2025-04-01优时比全身型重症肌无力药物优迪革在华获批,加速战略转型与罕见病领域布局
与常规治疗药物联合用于治疗乙酰胆碱受体(AChR)或肌肉特异性受体酪氨酸激酶(MuSK)抗体阳性的成人全身型重症肌无力(gMG)患者。
2025-03-31最新临床试验表明:英飞凡免疫疗法的中国患者临床获益趋势与全球患者一致
ADRIATIC III期临床试验表明,英飞凡是首个且唯一为局限期小细胞肺癌患者带来生存获益的免疫疗法。
2025-03-29康可期在华获批用于未经治疗的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者
ChangE III期临床试验结果显示,康可期降低了初治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者92%的疾病进展或死亡风险。
2025-03-27阿斯利康呼吸领域首款生物制剂在华上市,用于重度嗜酸粒细胞性哮喘(SEA)的维持治疗
阿斯利康宣布重度嗜酸粒细胞性哮喘(SEA)创新靶向生物制剂凡舒卓(通用名:本瑞利珠单抗注射液)在中国正式商业上市,用于成人和12岁及以上青少年重度嗜酸粒细胞性哮喘的维持治疗。
2025-03-24吉利德宣布拓达维新适应症在中国获批,用于治疗转移性HR+/HER2-乳腺癌患者
拓达维(英文商品名Trodelvy,戈沙妥珠单抗)获得中国国家药品监督管理局(NMPA)批准。
2025-03-21全球首发!强生旗下特诺雅达、特诺雅获批成为中国首个用于克罗恩病的白介素23抑制剂
用于治疗对传统治疗或生物制剂应答不充分、失应答或不耐受的中度至重度活动性克罗恩病成人患者。
2025-02-25赛诺菲抗CD38单抗赛可益在中国获批一线适应症
赛可益获批成为中国首个且目前唯一与标准治疗VRd联合的抗CD38单抗,治疗不适合自体干细胞移植的新诊断的多发性骨髓瘤成人患者。
2025-01-24全球首个口服GLP-1RA诺和忻在中国全面上市
全球首个口服胰高糖素样肽-1受体激动剂(GLP-1RA)——诺和忻(司美格鲁肽片)在中国全面上市。
2025-01-13首个用于治疗FGFR基因变异局部晚期或转移性尿路上皮癌患者 的靶向药物博珂(厄达替尼片)在华获批
厄达替尼片是一款新型靶向治疗药物,可显著改善携带FGFR3基因变异患者的总生存期和无进展生存期,为既往治疗选择有限的患者提供了全新的治疗方案。
2025-01-13填补市场空白,呼吸道感染康复期用药“益气清肺颗粒”获批上市
益气清肺颗粒正式获批上市。
2025-01-12葛兰素史克HIV暴露前预防长效药物艾普特(卡替拉韦注射液)在中国上市
HIV暴露前预防长效药物艾普特正式上市,用于有感染风险的成人和青少年进行HIV-1暴露前预防。
2025-01-10拜耳诺倍戈(达罗他胺片)第三项适应症注册申请获NMPA受理,实现新适应症全球同步递交
诺倍戈(达罗他胺)联合雄激素剥夺疗法(ADT)治疗转移性激素敏感性前列腺癌(mHSPC)成年患者的新适应症申请已获国家药品监督管理局(NMPA)药品审评中心(CDE)受理。
2025-01-09赛诺菲血液肿瘤药物抗CD38单抗赛可益在华获批
成为首个基于乐城真实世界研究数据作为关键证据获批的血液肿瘤治疗药物
2025-01-09利普卓在我国获批用于gBRCA突变HER2阴性早期高风险乳腺癌的辅助治疗
首个且唯一获批针对早期乳腺癌BRCA突变的靶向治疗药物,OlympiA III期临床研究显示,利普卓可将疾病复发风险降低42%,死亡风险降低32%
2025-01-03华东医药重组A型肉毒毒素上市申请获国家药品监督管理局受理
注射用重组A型肉毒毒素YY001用于改善中度至重度眉间纹的上市许可申请,获国家药品监督管理局受理。
2025-01-02罗氏又一款CD20/CD3双特异性抗体中国获批 T细胞疗法将给复发难治性滤泡性淋巴瘤带来临床新选择
作为全球首款获批用于滤泡性淋巴瘤(FL)治疗的CD20/CD3双特异性抗体(以下简称“双抗”),莫妥珠单抗是继格菲妥单抗之后,罗氏在中国连续第二年获批的第二款CD20/CD3双抗药物。
2024-12-23惠及银屑病儿童!国内首个乌司奴单抗生物类似药新适应症补充申请获受理
此次国内首个乌司奴单抗注射液生物类似药新适应症获受理,有望进一步提升产品覆盖人群,提高国内用药的可及性,补位更多临床治疗中的需求空缺。
2024-12-02全球首个卵巢癌ADC药物在中国获批上市
1月27日,华东医药宣布,其全球首创(First-in-class)药物索米妥昔单抗注射液(爱拉赫/ELAHERE)获国家药品监督管理局(NMPA)批准,用于既往接受过1-3线系统性治疗的叶酸受体α阳性的铂类耐药卵巢癌(PROC)适应症。
2024-11-27雅培亮相第七届进博会 以创意健康空间 展创新生命科技
全球领先的医疗健康公司雅培再赴“中国之约”,以“科技星河 健康无限”为主题亮相第七届中国国际进口博览会。
2024-11-06“中国同创”项目首个成果进博首展!全球首个胰岛素周制剂诺和期月底上市
诺和诺德公司召开新闻发布会并宣布,在本届进博会首展的全球首个胰岛素周制剂诺和期(依柯胰岛素注射液)将于2024年11月底在中国商业上市。
2024-11-06国内首个乌司奴单抗生物类似药获批上市,用于治疗成年中重度银屑病
乌司奴单抗生物类似药获批上市,进一步提高国内病人用药的可及性,补位更多临床治疗中的需求空缺。
2024-11-05礼来首个且唯一非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)在中国获批
捷帕力(匹妥布替尼)是全球首个获批用于既往接受过共价 BTK 抑制剂治疗的套细胞淋巴瘤患者的BTK抑制剂。
2024-10-30云顶新耀肾病核心产品耐赋康再添重磅利好 将推动商业化预期上升
全球首个IgA肾病对因治疗药物耐赋康在ASN年会上公布最新分析结果:再次证实其源头治疗机制,且不影响全身免疫系统
2024-10-30百济神州PD-1在美国开出首张处方
替雷利珠单抗于2024年3月获得美国食品药品监督管理局(FDA)批准,用于治疗既往接受过系统化疗(不含PD-1/L1抑制剂)后不可切除或转移性食管鳞状细胞癌(ESCC)的成人患者。
2024-10-28灵北偏头痛创新治疗药物艾普奈珠单抗落地粤港澳大湾区
近日,灵北公司用于成人偏头痛预防性治疗的创新药物艾普奈珠单抗(Eptinezumab)通过“港澳药械通”正式落地粤港澳大湾区中山大学孙逸仙纪念医院。
2024-10-23治疗BRCA突变转移性去势抵抗性前列腺癌的复方制剂泽倍珂在华获批
泽倍珂是每日一次的口服复方制剂,用于联合泼尼松或泼尼松龙一线治疗携带BRCA1/2突变的转移性去势抵抗性前列腺癌成人患者,临床证实其相较标准治疗可显著延长影像学无进展生存期。
2024-10-21第一三共创新药物德力静(苯磺酸美洛加巴林片)在中国成功商业上市
用于治疗成人糖尿病性周围神经病理性疼痛。
2024-10-18国内首个!德曲妥珠单抗推动HER2突变非小细胞肺癌精准治疗发展
这是中国首次批准的HER2突变肺癌靶向治疗药物,填补了该领域长期以来的治疗空白,为HER2突变NSCLC患者提供了新的生存希望。
2024-10-14罗氟司特乳膏两项适应症获批临床,有望惠及更多自身免疫疾病患者
国家药品监督管理局(NMPA)核准签发的两项《药物临床试验批准通知书》, 由中美华东申报的0.15%罗氟司特乳膏和0.3%罗氟司特乳膏临床试验申请获得批准。
2024-09-29优时比比奇珠单抗放射学阴性中轴型脊柱关节炎新适应症获批
中国首个且唯一覆盖中轴型脊柱关节炎全病程双靶点生物制剂。
2024-09-14ESC 2024:拜耳非奈利酮显著改善常见成人心衰患者心血管结局
非奈利酮是一种非甾体选择性盐皮质激素受体(MR)拮抗剂,是首个在针对左心室射血分数(LVEF)≥40% ,即 LVEF 轻度降低或保留的心衰患者的 III 期临床研究中被证明有确切心血管获益的 MR 拮抗剂。
2024-09-03低磷酸酯酶症药Strensiq依托“港澳药械通”政策先行引入大湾区
为罹患这一罕见病的患者群体实现新药可及。
2024-08-21新一代ADC药物优赫得在华又一突破!第三个适应症获批用于治疗HER2阳性晚期胃癌患者
HER2阳性晚期胃癌适应症是优赫得在中国获批的第三个重磅新适应症,也意味着第一三共在中国正式跨入第二个肿瘤疾病治疗领域。
2024-08-13优赫得在华获批用于既往接受过治疗的 HER2 阳性晚期或转移性胃癌患者
基于DESTINY-Gastric06的临床结果,德曲妥珠单抗可为患者带来具有临床意义的获益.
2024-08-13远离疼痛 更静一步:德力静上市,为DPNP患者带来更多长期获益
据国内PDNSCOPE研究显示,高达73.11%的DPNP患者存在这种中至重度持续性疼痛,但不足20%患者接受了DPNP处方药物治疗。
2024-07-30优时比倍捷乐强直性脊柱炎适应证获批上市,患者迎来治疗新突破
全球首个且唯一获批白介素17A/F双靶点抑制剂。
2024-07-19重组A型肉毒毒素全球首个医疗适应症在中国获批
近日,注射用重组A型肉毒毒素YY001-002用于“治疗成人上肢肌肉痉挛”的新适应症临床试验申请已获得国家药监局药品审评中心CDE批准。
2024-07-19拜耳达罗他胺达到转移性激素敏感性前列腺癌患者III期ARANOTE试验的主要终点
ARANOTE试验达到主要终点,与安慰剂加雄激素剥夺疗法(ADT)相比,达罗他胺+ ADT显著提高了影像学无进展生存期(rPFS)。
2024-07-18元羿生物泽元安(加那索龙口服混悬剂)获批,CDKL5缺乏症患者治疗重燃希望
这是全球首个也是目前国内唯一一个获批用于治疗CDKL5缺乏症(或称为“希舞综合征”)患者癫痫发作的药物,将造福于中国患者和家庭,用于治疗严重而罕见的遗传性神经发育性疾病。
2024-07-16德力静(苯磺酸美洛加巴林片)获批成人糖尿病性周围神经病理性疼痛适应症 开启“糖痛”管理治疗新格局!
该适应症的获批是糖尿病性周围神经病理性疼痛领域中的重要里程碑,打破了该疾病多年以来的治疗困境,拓宽了我国糖尿病性周围神经病理性疼痛管理治疗新格局。
2024-07-05礼来Kisunla获美国FDA批准用于治疗早期症状性阿尔茨海默病
美国食品药品监督管理局(FDA)批准Kisunla用于治疗成人早期症状性阿尔茨海默病(AD)。
2024-07-04全球首个三代EGFR-TKI肺癌靶向药物泰瑞沙联合化疗一线治疗EGFR突变晚期非小细胞肺癌的适应症在中国获批
基于FLAURA2研究,与泰瑞沙单药相比,泰瑞沙联合化疗作为一线治疗可将中国晚期EGFR突变非小细胞肺癌患者的疾病进展或死亡风险降低近一半。
2024-06-27首个治疗多发性骨髓瘤的BCMA×CD3双抗泰立珂在华获批
为治疗选择有限的复发或难治性多发性骨髓瘤患者带来全新治疗选择
2024-06-25Isa-Pd联合疗法真实世界研究数据亮相EHA,复发或难治性多发性骨髓瘤客观缓解率达82.6%
IsaFiRsT研究数据显示,新一代CD38单抗Isatuximab与泊马度胺和地塞米松的联合疗法(Isa-Pd)对于中国复发或难治性多发性骨髓瘤(RRMM)患者客观缓解率(ORR)达82.6%。
2024-06-15诺华创新药飞赫达在华获批开创PNH靶向治疗新时代,“跑步入场”惠及中国患者
用于治疗既往未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)成人患者。
2024-04-28欧洲监管机构建议批准Awiqli(基础胰岛素周制剂依柯胰岛素)用于治疗糖尿病
建议给予Awiqli(基础胰岛素周制剂依柯(icodec)胰岛素)用于治疗成人糖尿病的上市许可。
2024-03-22中国12岁及以上青少年AD患者可用“突破性疗法”, 希必可青少年新适应症正式获批
特应性皮炎发作带来的瘙痒、皮损会给青少年带来沉重的身心负担,快速有效地缓解症状和长期安全地控制疾病对青少年患者而言尤其重要。
2024-03-04武田创新药物替度格鲁肽中国获批! 改写“短肠人”被输液袋困住的命运
瑞唯抒(通用名:注射用替度格鲁肽)正式获得中国国家药品监督管理局批准,适用于治疗短肠综合征成人和1岁及以上儿童患者。
2024-02-23Datopotamab deruxtecan 生物制品许可申请在美国被受理, 用于既往接受过治疗的晚期非鳞状非小细胞肺癌患者
申请基于 TROPION-Lung01 III 期研究结果提出,若获批,阿斯利康和第一三共的 datopotamab deruxtecan 可能成为首个用于肺癌患者的靶向TROP2抗体偶联药物。
2024-02-22全新机制抗病毒药物马立巴韦片开出全国首处方, 填补移植后难治性CMV临床治疗空白
标志着这一创新药物在中国投入临床使用,为我国难治性CMV感染或疾病的成人移植受者带来治疗新选择。
2024-02-08全新一代CGRP受体拮抗剂乐泰可在中国获批 开启偏头痛特异性治疗口服靶向药新时代
今日,辉瑞公司宣布全新一代特异性偏头痛治疗药物乐泰可(瑞美吉泮口崩片)获得中国国家药品监督管理局批准,用于成年人有或无先兆偏头痛的急性治疗。
2024-01-26新可来(美泊利珠单抗注射液)在中国获批用于治疗重度嗜酸粒细胞性哮喘
美泊利珠单抗注射液是中国首个用于治疗重度嗜酸粒细胞性哮喘的抗白细胞介素-5(IL-5)靶向生物制剂。
2024-01-10阿尔茨海默病治疗新希望,全球首款阿尔茨海默病靶向药乐意保(仑卡奈单抗)在中国获批
作为全球首个针对AD病因的突破性靶向药物,乐意保的获批将引领AD治疗跨入“对因治疗”新时代,为中国AD患者提供更优治疗选择。
2024-01-09首个呼吸道合胞病毒预防手段在华获批!打一针即可保护婴儿度过合胞病毒危险期
首个针对所有婴儿的呼吸道合胞病毒预防手段乐唯初(尼塞韦单抗注射液)获得中国国家药品监督管理局批准上市。
2024-01-02- 武田全新机制抗病毒药物马立巴韦片中国正式获批 满足移植后巨细胞病毒感染治疗临床急需
CMV是一种常见的β-疱疹病毒,可在40%-100%的成人人群中发现既往感染的血清学证据。
2023-12-26 开启“除幽”新篇章!武田富马酸伏诺拉生片根除幽门螺杆菌新适应症在中国获批
以富马酸伏诺拉生片为基础的四联方案是国内目前首个获批的含铋四联方案,将为中国庞大的幽门螺杆菌感染人群提供“新武器”,开启“除幽”新篇章。
2023-11-24重磅!欧唐静(恩格列净)成人慢性肾病适应症在华获批
此次CKD适应症是继成人2型糖尿病、射血分数降低的成人心力衰竭和射血分数保留的成人心力衰竭、联合胰岛素治疗2型糖尿病之后,欧唐静在中国获批的又一个新适应症。
2023-11-24君实生物新冠口服药民得维第2项三期研究结果荣登《柳叶刀-感染病学》
国际感染病学期刊排名第一的《柳叶刀-感染病学》发布了国产新冠口服药民得维的一项Ⅲ期临床研究的完整数据。
2023-11-23成人2型糖尿病复方制剂安达释正式在华上市 为中国糖尿病患者带来控糖护心肾治疗新选择
达格列净二甲双胍缓释片是一种复方制剂,其结合了两种作用机制互补的抗高血糖药物:达格列净(商品名:安达唐),一种钠-葡萄糖协同转运蛋白-2(SGLT2)抑制剂。
2023-11-23创新治疗药物兆珂速在华上市 开启多发性骨髓瘤治疗新格局
填补原发性轻链型淀粉样变治疗空白。
2023-11-09广东多家医院高水平通过FDA核查,助力中国首个自研自产创新生物药成功出海
“国际品质,实力定益”拓益鼻咽癌适应证美国获批上市新闻发布会在广州顺利召开。
2023-11-06“免疫+靶向”联合治疗新突破 有望改变中国人群RCC一线治疗标准
我国自主研发的PD-1免疫治疗药物特瑞普利单抗联合阿昔替尼对比舒尼替尼一线治疗不可切除或转移性肾细胞癌(RCC)患者的RENOTORCH研究结果,以优选口头报告亮相全球学术盛会欧洲肿瘤内科学会(ESMO)年会。
2023-10-22- 全球首款口服TYK2变构抑制剂颂狄多(氘可来昔替尼片)中国获批
颂狄多的出现将在疗效、安全性及便捷性上带给银屑病患者全新口服治疗体验,丰富治疗选择以更好满足患者多元化、个体化治疗需求。
2023-10-20 舒立瑞在华获批治疗成人视神经脊髓炎谱系疾病
此次获批进一步深化了阿斯利康对全球罕见病患者的承诺。。
2023-10-20- 欧加隆创新降脂复方制剂益立妥成功在华获批,破解降脂难题
创新复方制剂益立妥的获批,将为破解降脂难题带来治疗新选择。
2023-09-19 - 拜耳可申达(非奈利酮)纳入欧洲心脏病学会最新临床指南
ESC 指南发布1A级建议,推荐与2型糖尿病相关的慢性肾脏病患者使用非奈利酮和/或 SGLT2 抑制剂进行治疗。
2023-09-07 阿贝西利片扩展适应症在华获批,惠及更多高危早期乳腺癌患者
此次扩展适应症的获批是基于monarchE研究的4年数据。
2023-09-05- 最新研究数据显示,重组带状疱疹疫苗欣安立适对中国50岁及以上成人具有100%保护效力
这是重组带状疱疹疫苗在中国开展的首个保护效力研究的数据。
2023-08-24 - 全球首创小干扰RNA降胆固醇药物乐可为在中国获批
一年两针有效降脂,助力患者血脂达标。
2023-08-23 - 安达唐在中国获批治疗成人症状性慢性心力衰竭 降低患者心血管死亡及住院风险
首个且唯一经证实可在全射血分数范围内降低心衰患者死亡率的心衰治疗药物现已获批
2023-08-18 - 优赫得在华获批作为首个针对HER2低表达转移性乳腺癌的抗HER2靶向疗法
重塑HER2乳腺癌治疗分型,HER2低表达乳腺癌患者也有望获益。
2023-07-13 - 优赫得在华获批!占一半乳腺癌患者的HER2低表达者迎来新疗法
优赫得作为全球首个针对HER2低表达转移性乳腺癌的靶向治疗在华获批。
2023-07-12 安达释在我国获批用于治疗成人2型糖尿病
此次获批标志着达格列净二甲双胍缓释片成为中国唯一一个每日一次、固定剂量的SGLT2抑制剂和盐酸二甲双胍缓释剂的复方制剂
2023-06-27- 美纳里尼第二代抗组胺药力敏能(比拉斯汀片)在中国获批,引领荨麻疹高品质诊疗新时代
第二代非镇静性的长效抗组胺药物力敏能(通用名:比拉斯汀片)正式获国家药品监督管理局(NMPA)批准上市,适用于12岁及以上青少年和成年人荨麻疹的对症治疗。
2023-06-26 Survodutide(BI 456906)II期试验显示,超重或肥胖受试者体重下降接近19%
在接受Survodutide(BI 456906)治疗的两个最高剂量组中,高达40%的受试者体重下降至少20%
2023-06-25优赫得在多个HER2表达的晚期实体瘤患者中表现临床意义和持续缓解
阿斯利康和第一三共联合开发的优赫得在DESTINY-PanTumor02 II期试验总人群中显示出37.1%的客观缓解率
2023-06-07- 特应性皮炎靶向生物制剂达必妥 6个月及以上婴幼儿新适应症在华获批
作为同类首个可用于6个月及以上婴幼儿的治疗用生物制剂,达必妥卓越的临床获益和安全性得到进一步证实,也开启了中国婴幼儿特应性皮炎治疗新篇章
2023-05-30 美泊利珠单抗治疗重度嗜酸粒细胞性哮喘的中国III期研究数据表现积极
近日,美国胸科学会(ATS)年会以海报形式公布了美泊利珠单抗中国III期随机对照试验积极结果。
2023-05-23- 拜耳asundexian的房颤临床项目获美国FDA快速通道资格
OCEANIC-AF(房颤)研究是III期 OCEANIC临床研究项目之一,该项目计划在40多个国家/地区招募27000多名患者。正在研发的Asundexian作为改善卒中预防的潜在疗法属于一种全新类型的血栓管理方式,目标是在保证疗效的同时不增加出血风险。
2023-05-22 拜耳非奈利酮获批可用于与2型糖尿病相关慢性肾脏病早期人群
中国国家药品监督管理局(NMPA)批准将可申达的适用人群扩展到与2型糖尿病相关的慢性肾脏病早期阶段,并且适应症中纳入心血管相关获益。
2023-05-18中国首部《青少年成人脊髓性肌萎缩症临床诊疗指南》正式发布
多学科专家协力,推动罕见病SMA规范化诊疗发展
2023-05-14- CLL/SLL和WM全线患者迎来“同类最优”药物,让长生存和更高生活质量成为可能
泽布替尼获批新适应症,开启中国CLL/SLL和WM患者全线治疗新篇章。
2023-05-09 - 科赛优在中国获批用于治疗伴有丛状神经纤维瘤的I型神经纤维瘤病儿童患者
中国首个也是唯一一个获批用于治疗罕见的、进行性遗传疾病药物,该疾病会导致丛状神经纤维瘤沿神经丛生长SPRINT研究结果显示科赛优可缩减神经纤维瘤体积,帮助缓解疼痛、功能障碍和其他临床并发症。
2023-05-08 进口原研13价肺炎球菌结合疫苗扩年龄新适应症正式获批!
扩龄至5岁,更多中国儿童可以获得高质量免疫保护
2023-04-20- 重度斑秃有救了!脱发新药中国获批上市
作为首款用于系统性治疗成人重度斑秃的靶向药物,此次艾乐明新适应症获批填补了中国重度斑秃患者迫在眉睫的疾病治疗需求。
2023-03-28 - 新一代高选择性 BTK 抑制剂在中国获批上市 套细胞淋巴瘤患者将获益
这是阿可替尼在中国的首次获批,为患者提供较佳的生存预后并兼具良好的安全性
2023-03-24 拜耳诺倍戈激素敏感性前列腺癌国内获批,前列腺癌适应症进一步拓宽
国家药品监督管理局批准口服雄激素受体抑制剂(ARi)诺倍戈(达罗他胺)联合多西他赛治疗转移性激素敏感性前列腺癌(mHSPC)的成年患者。
2023-03-20诺倍戈(达罗他胺)新适应症欧盟获批 转移性激素敏感性前列腺癌患者将获益
欧盟委员会批准诺倍戈(达罗他胺)用于治疗转移性激素敏感性前列腺癌(mHSPC)的患者,此次批准基于III期ARASENS试验数据。
2023-03-07- 又一款新药纳入医保,2型糖尿病肾病患者将获益
拜耳公司用于治疗与2型糖尿病相关的慢性肾脏病的可申达(非奈利酮片)纳入其中,价格从原来的每盒400多元大幅下降近80%。
2023-03-01 新一代ADC药物优赫得在华获批,晚期乳腺癌迎来治疗新希望!
本品单药适用于治疗既往接受过一种或一种以上抗HER2药物治疗的不可切除或转移性HER2阳性成人乳腺癌患者。
2023-02-25- 莫诺拉韦胶囊在我国获应急附条件批准,用于治疗新冠患者
抗新冠病毒口服药物莫诺拉韦胶囊(商品名:利卓瑞/LAGEVRIO)已获得中国国家药品监督管理局(NMPA)应急附条件批准,用于治疗成人伴有进展为重症高风险因素的轻至中度新型冠状病毒感染(COVID-19)患者。
2022-12-30 《新英格兰医学杂志》发表口服抗新冠病毒药物VV116对比PAXLOVID治疗伴有高风险因素的轻/中度COVID-19患者III期临床研究结果
这是NEJM发表的首个中国自主研发的新冠创新药临床试验。
2022-12-29Capivasertib联合芙仕得与芙仕得相比降低晚期HR阳性乳腺癌40%的疾病进展或死亡风险
在SABCS 2022上公布的CAPItello-291III期试验结果显示capivasertib具有作为first-in-class AKT激酶抑制剂的潜力
2022-12-12Enhertu在DESTINY-Breast03中延长HER2阳性转移性乳腺癌统计学意义上总生存,比T-DM1降低死亡风险36%
阿斯利康和第一三共的Enhertu在DESTINY-Breast03 III期临床研究中,与T-DM1相比将既往接受过HER2靶向疗法患者的无进展生存期延长了22个月
2022-12-12莫格利珠单抗在中国获批,用于治疗复发或难治性Sézary综合征或晚期蕈样肉芽肿
莫格利珠单抗获批用于治疗既往接受过系统性治疗的两种最常见皮肤T细胞淋巴瘤患者。相关临床研究数据显示,莫格利珠单抗组患者的无进展生存期和总缓解率均优于伏立诺他组。
2022-10-27最新研究数据显示:重组带状疱疹疫苗欣安立适能够为50岁及以上成人提供至少10年的保护
就主要研究终点而言,此次中期研究数据表明,在初次接种后约6至10年的随访期间,欣安立适对带状疱疹的总体保护效力超过80%
2022-10-21全球首创降糖新药华堂宁获批, 拜耳建立糖尿病全病程管理模式
国家药品监督管理局批准糖尿病全球首创新药华堂宁(多格列艾汀片),用于单独用药,或者在单独使用盐酸二甲双胍血糖控制不佳时,与盐酸二甲双胍联合使用,配合饮食和运动改善成人2型糖尿病患者的血糖控制。
2022-10-09利普卓在中国获批与贝伐珠单抗联合用于HRD阳性晚期卵巢癌一线维持治疗
PAOLA-1 III期试验的长期随访结果显示出临床生存获益
2022-09-22特瑞普利单抗联合化疗用于一线治疗肺癌患者获得国家药品监督管理局批准
这是特瑞普利单抗在中国获批的第六项适应症,将为中国晚期非小细胞肺癌患者带来更多治疗选择。
2022-09-20阿柏西普8毫克制剂首次达到在89%的患者中延长注射间隔达16周
在新生血管(湿性)年龄相关性黄斑变性(nAMD)和糖尿病性黄斑水肿(DME)的两项全球关键研究中,阿柏西普8 mg达到了主要终点,相较于艾力雅(阿柏西普2 mg),在第48周最佳矫正视力获得非劣性改善。
2022-09-13泰瑞沙辅助治疗EGFR突变肺癌患者的中位无病生存期长达5.5年
近3/4接受奥希替尼辅助治疗的患者在4年时仍存活且无疾病进展,探索性结果显示奥希替尼还能降低II-IIIA期患者的脑部或脊髓复发风险达76%。
2022-09-13用于治疗成年中重度斑块状银屑病患者的口服药物获美国FDA批准
这是目前全球唯一获批的TYK2抑制剂,也是近10年来首个用于治疗中重度斑块状银屑病的创新口服药物。
2022-09-13达格列净慢性肾脏病适应症在中国获批
此次获批标志着达格列净成为首个在中国获批用于治疗成人慢性肾脏病的SGLT2抑制剂
2022-09-05重磅!欧唐静(恩格列净片)在华获批射血分数保留的成人心力衰竭适应症
欧唐静是首个且目前唯一经研究验证的针对所有症状性慢性心力衰竭的SGLT-2抑制剂,为中国心衰患者提供全新的治疗选择
2022-08-30阿斯利康中国首个罕见病药物舒立瑞在华收获里程碑进展,为罕见病治疗提供新选择
今日,中国国家药品监督管理局批准依库珠单抗(Eculizumab)注射液(商品名:舒立瑞)通过原液新产地的变更申请。
2022-08-30Enhertu在美国获批作为首个针对HER2低表达转移性乳腺癌患者的 HER2靶向疗法
根据DESTINY-Breast04结果显示,阿斯利康与第一三共联合开发的Enhertu与化疗相比,将疾病进展或死亡风险降低了50%,并将总生存期延长了6个月以上。
2022-08-18泛肿瘤TRK抑制剂罗圣全在中国获批,开启个体化医疗新篇章
泛肿瘤TRK抑制剂罗圣全在中国获批,适用于经充分验证的检测方法诊断为携带神经营养酪氨酸受体激酶融合基因且不包括已知获得性耐药突变,患有局部晚期、转移性疾病或手术切除可能导致严重并发症,以及无满意替代治疗或既往治疗失败的成人和12岁及以上儿童实体瘤患者。
2022-07-29骨髓瘤迎来新药,塞利尼索片中国上市
2022年7月24日,抗肿瘤药物希维奥于武汉隆重举行中国上市会。
2022-07-25全球首款FcRn拮抗剂国内上市申请获受理,用于治疗全身型重症肌无力
7月13日,国家药品监督管理局正式受理了全球首款FcRn拮抗剂efgartigimod的新药上市申请,用于治疗全身型重症肌无力。这也是国内首款新药上市申请获受理的FcRn拮抗剂。
2022-07-14非奈利酮片获批上市,用于与2型糖尿病相关的慢性肾脏病
慢性肾病是糖尿病患者最常见的并发症,也是心血管疾病的独立危险因素。大约40%的2型糖尿病患者会发展成为慢性肾病。即使按照指南进行治疗,与2型糖尿病相关的慢性肾脏病患者也处于慢性肾病进展和发生心血管事件的高风险中。
2022-06-29百时美施贵宝PD-1抑制剂新增两项食管癌新适应证
欧狄沃(及其联合治疗方案)是目前唯一同时覆盖食管癌辅助治疗和晚期一线治疗的PD-1/PD-L1抑制剂;且全面覆盖了上消化道肿瘤一线治疗(无论肿瘤部位与组织学分型)。
2022-06-29拉罗替尼口服溶液国内获批,NTRK基因融合实体瘤儿童重获新生不再是梦想
2022年6月24日—拜耳今日宣布,国家药品监督管理局批准肿瘤精准治疗药物维泰凯(拉罗替尼)口服溶液适用于符合下列条件的成人和儿童实体瘤患者。
2022-06-27PD-1抑制剂达伯舒一线治疗胃腺癌适应症获批上市
2022年6月24日,礼来制药和信达生物制药集团共同宣布,PD-1抑制剂达伯舒获批联合含氟尿嘧啶类和铂类药物化疗用于不可切除的局部晚期、复发或转移性胃及胃食管交界处腺癌的一线治疗。
2022-06-24达伯舒联合化疗用于一线治疗食管鳞癌 获得国家药品监督管理局批准上市
创新药物PD-1抑制剂达伯舒(信迪利单抗注射液)获得中国国家药品监督管理局(NMPA)批准,联合紫杉醇和顺铂或氟尿嘧啶和顺铂用于不可切除的局部晚期、复发或转移性食管鳞癌的一线治疗。
2022-06-20多城联动,急性白血病新药贝博萨在中国上市
6月19日,辉瑞急性白血病创新药贝博萨(注射用奥加伊妥珠单抗)上市会成功召开,4城“线上+线下”联动,同时开启全新的治疗时代,也标志着血液肿瘤向前迈出了新的一大步。
2022-06-20渤健多发性硬化高峰论坛暨氨吡啶缓释片上市会今日召开
渤健氨吡啶缓释片今日上市!
2022-06-12重磅!“明星药”恩格列净又一适应症在中国获批
据统计,中国约有890万心力衰竭患者。随着人口老龄化日趋加深,使得心衰“后备军”队伍庞大。恩格列净片于2017年首次在中国市场获批,用于治疗成人2型糖尿病患者。
2022-06-10白血病告别化疗?Calquence联合奥妥珠单抗患者5年生存率达到90%
Calquence联合奥妥珠单抗作为CLL一线疗法在 ELEVATE-TN试验中显示出持续生存获益:5年生存率达到90%,在ASCEND 试验针对既往接受过治疗的患者中,acalabrutinib治疗组在第4年仍保持疗效和持续安全性。
2022-06-07为肺纤维化按下暂停键!新型PDE4B抑制剂可显著延缓IPF患者肺功能下降
2022年5月15日,勃林格殷格翰在《新英格兰医学杂志》上公布了BI 1015550的Ⅱ期数据。
2022-05-26维立西呱片获批上市,中国慢性心衰患者迎来新选择
中国药品监督管理局已经批准唯可同(维立西呱片)2.5mg,5mg和10mg的上市申请,用于近期心力衰竭失代偿经静脉治疗后病情稳定的射血分数降低(射血分数<45%)的症状性慢性心力衰竭成人患者。
2022-05-19Enhertu在美国获批用于既往接受过抗HER2治疗方案的HER2阳性转移性乳腺癌患者
阿斯利康和第一三共的Enhertu获批扩展适应症,使其更早用于转移性乳腺癌。基于突破性的 DESTINY-Breast03试验结果显示,Enhertu与恩美曲妥珠单抗(T-DM1)相比将疾病进展或死亡风险降低72%。
2022-05-13美国FDA接受达罗他胺联合多西他赛治疗转移性激素敏感性前列腺癌的补充新药申请
拜耳近日宣布美国食品药品监督管理局(FDA)已接受口服雄激素受体抑制剂(ARi)达罗他胺联合多西他赛治疗转移性激素敏感性前列腺癌(mHSPC)的补充新药申请并授予优先审评资格。
2022-05-07肺癌创新药第三代ALK抑制剂博瑞纳在中国获批
博瑞纳一线研究最新3年临床研究数据显示,ALK阳性晚期非小细胞肺癌患者无进展生存期(PFS)取得重大进展。
2022-04-29中国首款自研P-CAB替戈拉生片获批 开启抑酸治疗新时代
据悉,替戈拉生片是中国首款自研的钾离子竞争性酸阻滞剂(P-CAB),具有30分钟快速起效、强效持久抑酸、服用方便等特点,为治疗反流性食管炎、改善患者的生活质量带来全新的用药选择。
2022-04-13又有一新药获批!泛癌种患者多了新选择!
作为首个口服TRK抑制剂,是专门用于治疗具有NTRK基因融合肿瘤的泛瘤种精准靶向治疗药物。拉罗替尼在TRK融合的成人和儿童肿瘤患者,包括中枢神经系统(CNS)肿瘤中均显示出高效和持久的应答,目前已经在美国、欧盟和英国等国家和地区获批。
2022-04-13狼疮肾炎迎靶向治疗时代,首款狼疮肾炎的生物制剂在中国上市
贝利尤单抗是全球及中国首款获批用于治疗系统性红斑狼疮和成人狼疮肾炎的药物。
2022-04-06快速终止癫痫发作!优时比阿普唑仑创新吸入式疗法纳入突破性治疗品种
今日,国家药品监督管理局药品审评中心对优时比新药Staccato(阿普唑仑吸入粉剂)“突破性治疗”的认定正式生效,拟定适应症为“快速终止12周岁及以上患者的刻板性癫痫长时间发作”。
2022-03-30解决耐药问题!ALK阳性晚期非小细胞肺癌患者迎来全新治疗选择
近年来,肺癌的治疗取得了很大的进步,其中就表现在很多肺癌都相应的找到了靶向突出,有了靶向药物治疗。
2022-03-29新的独立研究显示Evusheld长效抗体组合药物对包括BA.2在内的奥密克戎变异株具有中和活性
盛顿大学首个体内试验数据显示,对所有受试的奥密克戎(Omicron)变异株亚系,Evusheld减少了肺部的病毒载量。
2022-03-29诺华达拉非尼联合曲美替尼双靶组合疗法新适应症获批,肺癌患者迎来新选择
泰菲乐(甲磺酸达拉非尼胶囊)和迈吉宁(曲美替尼片),于日前获国家药品监督管理局批准新增适应症,用于治疗BRAF V600突变阳性转移性非小细胞肺癌。
2022-03-25多发性硬化突破性创新药在华开出首张处方
全球唯一为多发性硬化患者定制的全人源CD20单抗,为患者带来精准治疗选择
2022-03-24赛诺菲抗心律失常创新药物迈达龙在华上市,开启中国房颤治疗新局面
赛诺菲旗下抗心律失常药物盐酸决奈达隆片正式登录中国。
2022-03-21关注肺癌患者治疗,肺癌创新药卡马替尼落地大湾区
治疗非小细胞肺癌药物Tabrecta(卡马替尼,Capmatinib)日前顺利被纳入粤港澳大湾区内地临床急需进口港澳药品医疗器械第二批目录,获批在广州现代医院使用.
2022-03-17儿童静脉血栓栓塞症有了新疗法,拜瑞妥在中国获批新适应症
拜瑞妥(利伐沙班片)在中国获批用于18岁以下且体重为30kg-50kg及50kg以上的儿童和青少年静脉血栓栓塞症(VTE)患者经过初始非口服抗凝治疗至少5天后的VTE治疗及预防VTE复发。
2022-03-16阿贝西利片开启HR+, HER2-早期乳腺癌高危患者辅助治疗新时代
礼来制药CDK4 & 6抑制剂唯择(阿贝西利片)早期乳腺癌适应症在中国正式上市。
2022-03-07肿瘤新药在博鳌乐城落地, 加速惠及HER2阳性乳腺癌及胃癌患者
近日,第一三共(中国)与阿斯利康全球合作开发推广的靶向HER2的抗体偶联药物trastuzumab deruxtecan(Enhertu,T-DXd,又称DS-8201)在海南博鳌乐城国际医疗旅游先行区落地。
2022-03-03首个中国原研CDK4/6抑制剂羟乙磺酸达尔西利片开出首日处方 为我国乳腺癌患者带来生命福音
近日,由首个中国原研CDK4/6抑制剂羟乙磺酸达尔西利片(商品名:艾瑞康️)由中国医学科学院肿瘤医院徐兵河院士团队开出全国首日处方。
2022-02-25适用人群再拓宽 特应性皮炎靶向生物制剂达必妥在华获批儿童适应症
研究显示,接受达必妥和TCS联合治疗组中皮损得到清除或几乎清除的患者人数是TCS单药组的两倍多,瘙痒程度显著缓解的患者人数是TCS单药组的四倍多,疾病总体改善程度至少达75%的患者人数近四分之三,平均改善程度达到约80%,且安全性与成人和青少年相似。
2022-02-24非奈利酮在欧盟获批用于慢性肾病伴2型糖尿病成人患者
非奈利酮在获得美国FDA批准后,最近被新发布的美国糖尿病协会“慢性肾病和风险管理”指南列为A级推荐,用于有心血管事件和慢性肾病进展风险的慢性肾病伴2型糖尿病患者。
2022-02-21前列腺癌一线治疗!奥拉帕利联合疗法显著降低疾病进展风险达34%
与单用阿比特龙治疗的患者相比,联合疗法耐受性良好,患者能够保持生活质量。PROpel III 期试验结果显示,无论同源重组修复基因突变,患者均可从联合疗法中获益。
2022-02-17一周一次重磅降糖新药诺和泰现可医保报销,惠及中国2型糖尿病患者
在糖尿病治疗领域,新型降糖药物诺和泰(司美格鲁肽注射液)因其显著的临床获益,上市不到4个月即被纳入国家医保目录报销体系,将进一步提高这款创新药的可及性。
2022-01-06康新博成为我国目前唯一可同时治疗成人患者侵袭性毛霉病和曲霉病的口服抗真菌药物
今日,国家药品监督管理局批准创新药物康新博(硫酸艾沙康唑胶囊,CRESEMBA,100 mg)用于治疗成人侵袭性曲霉病。
2022-01-06阿贝西利片新增早期乳腺癌适应症,开创HR+, HER2-早期乳腺癌高危患者辅助治疗新时代
近日,抗肿瘤新药唯择(阿贝西利片)获得国家药品监督管理局(NMPA)批准,联合内分泌治疗(他莫昔芬或芳香化酶抑制剂)适用于激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性、淋巴结阳性,高复发风险且Ki-67≥20%早期乳腺癌成人患者的辅助治疗.
2022-01-06卡马替尼落地博鳌,为非小细胞肺癌患者带来精准治疗新选择
诺华治疗非小细胞肺癌药物Tabrecta(卡马替尼,Capmatinib)日前顺利获准在海南博鳌乐城国际医疗旅游先行区特定医疗机构应用于临床急需,为中国内地的MET外显子14(METex14)跳跃突变的转移性非小细胞肺癌患者带来全球同步的精准治疗方式,帮助患者延长生命。
2022-01-05心血管创新药阿利西尤单抗迎来医保落地,惠及心血管患者
新版医保目录中用于降低低密度脂蛋白胆固醇水平的创新药阿利西尤单抗(波立达)可以开始使用医保报销。
2022-01-03新年新医保,银屑病患者收获全国首批医保处方
2022年1月1日起,《国家基本医疗保险、工伤保险和生育保险药品目录(2021年)》正式启用。
2022-01-02新版医保目录执行!乌司奴单抗等药品医保首方纷纷开出
今日起,《2021版国家医保药品目录》正式执行。
2022-01-01中国首个三代BCR-ABL 抑制剂开出首批处方,多家医院落地惠及患者
据悉,亚盛医药原创1类新药奥雷巴替尼(商品名:耐立克)已在全国多地同步开出首批处方单,并正式开始在多省市供药。
2021-12-31急性白血病 “破局者”! 创新药贝博萨在中国获批
贝博萨获批用于复发性或难治性前体B细胞急性淋巴细胞性白血病(ALL)成年患者。
2021-12-22“港澳药械通”造福民众 乳腺癌创新药Alpelisib获批引进粤港澳大湾区
粤港澳大湾区“港澳药械通”政策实施传来好消息:诺华治疗晚期乳腺癌的创新药Piqray(Alpelisib)于日前顺利获批引进粤港澳大湾区的香港大学深圳医院,内地患者可全球同步获益于创新药物。
2021-12-21全球首款FcRn拮抗剂efgartigimod获美国FDA批准用于治疗全身型重症肌无力
近日,全球首款FcRn拮抗剂efgartigimod获美国食品药品监督管理局(FDA)批准,用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)。
2021-12-21国内首个针对成人侵袭性毛霉病的口服抗真菌药物正式获批
辉瑞公司今日宣布,新型抗菌药物康新博于近日获得国家药品监督管理局批准,用于治疗成人侵袭性毛霉病。
2021-12-20新冠植物源性佐剂候选疫苗3期临床效力和安全性研究取得积极结果
对研究中检测的所有变异株均有效,包括由全球流行的德尔塔(Delta)变异株引起的任何严重程度的新冠肺炎,其效力为75.3%
2021-12-09放宽接种时间 全球首款双载体13价肺炎疫苗上市
12月4日,全球首款双载体13价肺炎疫苗在广州市宣布正式上市。
2021-12-05中国患者率先获益,特瑞普利单抗一线治疗鼻咽癌适应症获批
抗PD-1单抗药物特瑞普利单抗注射液(拓益)联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗的新适应症获得国家药品监督管理局(NMPA)批准。
2021-11-29新III 期临床研究启动评估维立西呱在射血分数降低慢性心衰患者中的应用
新的III 期VICTOR研究将评估维立西呱在近期未发生心衰加重事件患者中的疗效和安全性。
2021-11-15美国肾脏病学会发布新数据 强化非奈利酮在慢性肾病伴2型糖尿病患者中的肾脏和心血管获益
分析数据在美国肾脏病学会的 2021 年肾脏周上以两项口头报告和两项最新突破研究海报的形式呈现。
2021-11-11全球首个原发性轻链型淀粉样变治疗药物兆珂速在华获批
兆珂速近日获国家药品监督管理局批准,与硼替佐米、环磷酰胺和地塞米松联合用药治疗新诊断的原发性轻链型淀粉样变患者。
2021-10-12信迪利单抗联合化疗一线治疗胃癌临床研究数据公布
信迪利单抗联合化疗一线治疗胃癌临床研究数据在021年欧洲临床肿瘤年会(ESMO 2021)口头报告上公布。
2021-09-29HER-2阳性乳腺癌:Enhertu与T-DM1相比,可降低死亡风险72%
据悉,针对HER2阳性的乳腺癌患者一般使用曲妥珠单抗和紫杉类药物进行初始治疗,但 HER2 阳性转移性乳腺癌患者通常还是会出现疾病进展。需要更有效的治疗选择来进一步延缓进展并延长生存期。
2021-09-23新研究证实达罗他胺显著提高非转移性前列腺癌患者整体生存质量
在AUA上公布的III期ARAMIS试验分析,评估了达罗他胺对源自前列腺及邻近淋巴结和组织症状的影响,结果表明达罗他胺与局部尿路和肠道症状减轻以及局部侵入性操作减少相关
2021-09-22英飞凡联合化疗可3倍提升广泛期小细胞肺癌患者3年生存率
CASPIAN III期试验3年随访数据公布:英飞凡联合化疗3倍提升广泛期小细胞肺癌患者3年生存率,这也是目前PD-1/PD-L1小细胞肺癌研究中报告的随访最长生存期
2021-09-22新数据证实!非奈利酮可改善慢性肾病合并2型糖尿病患者的心血管结局
FIGARO-DKD研究详细数据证实非奈利酮在FIDELIO-DKD研究中表现出来的心血管获益,FIGARO-DKD研究关注从1期到4期不同疾病严重程度的慢性肾病合并2型糖尿病患者
2021-08-30中国银屑病患者迎来新口服药物 欧泰乐在华获批
据悉,阿普米司特是中国首个也是目前唯一一个获批用于斑块状银屑病治疗的口服磷酸二酯酶4(PDE4)抑制剂,口服每日两次、每次一片,无需用药前筛查及常规实验室监测。
2021-08-17多发性硬化迎来新药 短期改善行走功能,长期延缓疾病进展
MS是一种以中枢神经系统炎性脱髓鞘病变为主要特点的免疫介导性疾病,好发于20-40岁的中青年,是目前全球最常见的青壮年致残性神经系统疾病之一。
2021-08-01新一代血友病药物在我国上市,可有效降低抑制物形成
血友病是一种X染色体连锁的隐性遗传性出血性疾病,可分为甲型血友病和乙型血友病,一旦发病就会伴随终身。“受伤之后血流不止,不能磕碰的‘玻璃人’”……
2021-08-01慢性肾病患者福音,降磷药诺维乐国内获批
目前我国非透析慢性肾脏病患者高磷血症的患病率较高,但尚未得到充分的临床治疗。
2021-07-27欧盟批准维立西呱可用于症状性慢性心力衰竭患者
2021年7月22日,拜耳宣布欧盟委员会已经批准维立西呱(2.5毫克、5 毫克和 10 毫克)在欧盟地区的上市许可。
2021-07-22糖尿病肾病患者再添“利器”,又一新药获批上市
美国食品药品监督管理局(FDA)批准首个非甾体选择性盐皮质激素受体拮抗剂非奈利酮(Kerendia)在美国上市
2021-07-1210年来高血压迎来新药 沙库巴曲缬沙坦被证实降压更有效
近日,国家药品监督管理局批准诺欣妥(沙库巴曲缬沙坦)用于治疗原发性高血压。
2021-06-03利伐沙班+阿司匹林新型抗栓方案再添新证据
近日,39健康获悉III期临床VOYAGERPAD研究的新数据显示利伐沙班+阿司匹林够持续降低下肢血运重建后外周动脉疾病患者的严重血管事件。
2021-05-25糖尿病合并肾病治疗药物非奈利酮的心血管新证据公布
来自III期FIDELIO-DKD研究的预设探索性亚组分析的最新数据表明:与安慰剂相比,在患有慢性肾脏病和2型糖尿病的患者中,药物非奈利酮可降低新发房颤或房扑风险。
2021-05-20氨吡啶缓释片获批用于改善多发性硬化成年患者的步行能力
氨吡啶缓释片是中国首个获批的能够改善MS成人患者步行能力的治疗方法
2021-05-14血友病新药在华获批!A型血友病患者有望实现“零出血”
舒友立乐已获得中国国家药品监督管理局正式批准,用于不存在凝血因子VIII 抑制物的重度A 型血友病患者(先天性凝血因子VIII缺乏,FVIII<1%)成人及儿童患者的常规预防治疗
2021-05-07突破传统化疗局限,PARP抑制剂帕米帕利开启复发性卵巢癌治疗新时代
抗癌新药PARP抑制剂百汇泽(通用名:帕米帕利)正式通过国家药品监督管理局(NMPA)附条件批准。
2021-05-07兼顾降糖与护心,一周一次重磅降糖药在中国获批
国家药品监督管理局批准了司美格鲁肽注射液在中国的上市申请,作为一周一次给药的重磅GLP-1产品,为糖尿病患者治疗带来更多的选择。
2021-04-29针对复发或难治性多发性骨髓瘤患者 创新靶向药物在我国获批
达雷妥尤单抗注射获国家药品监督管理局批准,与来那度胺和地塞米松联合用药或与硼替佐米和地塞米松联合用药治疗既往至少接受过一线治疗的多发性骨髓瘤成年患者。
2021-04-29全病程只需口服一次!这款“全新作用机制”抗流感新药正式获批
据悉,玛巴洛沙韦是一款创新的帽状结构依赖性核酸内切酶抑制剂,是目前获批治疗流感的首个,也是唯一一个单剂量口服药物。
2021-04-29“双艾”方案,为肝癌患者带来“治疗奇迹”
近日,央视2套《经济半小时》栏目报道了“双艾”方案治疗肝癌患者事例,一时间引发了大量观众的热议。
2021-04-23我国自主研发治疗系统性红斑狼疮的创新药物上市
近日,我国自主研发的双靶点生物制剂泰它西普在国内首发上市,该药获批用于治疗系统性红斑狼疮,是全球首个用于治疗该病的双靶点生物制剂。
2021-04-20中国获批上市!多发性硬化患者等来又一新药
富马酸二甲酯肠溶胶囊(美国及欧盟注册商品名TECFIDERA,以下简称富马酸二甲酯)正式获得中国国家药品监督管理局批准,用于治疗复发型多发性硬化。
2021-04-16晚期或转移性尿路上皮癌患者或将迎来“新”的突破口
PD-1免疫治疗药物拓益尿路上皮癌适应症在中国获批,用于治疗既往含铂治疗失败的局部晚期或转移性尿路上皮癌患者。
2021-04-12遗传性血管性水肿有了新药,这种罕见病发作严重可致死亡
“以往对于遗传性血管性水肿的急性发作只能采用新鲜的血浆使水肿消退,但限制较多且易发生意外,中国医学科学院北京协和医院变态反应科支玉香教授说道。
2021-04-08肿瘤免疫治疗患者未来可以6周用药一次,覆盖多个瘤种
本次批准免疫治疗药物帕博利珠单抗新增400mg每6周一次的剂量方案在保障了规范用药的基础上降低用药频率,减少患者奔波的负担,正是多方共同努力提升患者生活质量的体现。
2021-03-1750%双相情感障碍患者被误诊为抑郁症,患者获新药选择
除却识别难、诊断难,双相情感障碍患者目前面临的另一大挑战是治疗选择的局限。目前国内双相情感障碍治疗控制躁狂发作的药物较多,但治疗双相抑郁的药物选择较少,且大多疗效有限。
2021-03-04EGFR突变阳性晚期非小细胞肺癌 我国新药取新突破
第三代EGFR-TKI阿美替尼一线治疗EGFR突变阳性局部晚期或转移性非小细胞肺癌(NSCLC)的Ⅲ期研究取得阳性结果。
2021-02-22全球首个鼻咽癌免疫疗法获批,晚期鼻咽癌获更长生存期
抗PD-1单抗药物特瑞普利单抗注射液(拓益)获得国家药品监督管理局(NMPA)批准,用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌(NPC)患者的治疗.
2021-02-20及早治疗可降低年复发率近80%,北京市特应性皮炎诊疗地图出炉
近年来,过敏、炎症等免疫相关疾病呈不断增长趋势。其中,主要由2型炎症反应引起的中重度特应性皮炎(AtopicDermatitis,AD),不但是皮肤病,更是系统性免疫性疾病。
2021-01-28短效β-受体激动剂已过时?轻度哮喘有了新药物
许多轻度哮喘患者因抗炎维持治疗处方不足或使用不足,过度依赖短效β2受体激动剂(SABA)缓解治疗,从而掩盖了症状恶化的潜在问题。
2021-01-27活动性狼疮性肾炎患者首款新药获批上市
贝利尤单抗是首款获批用于治疗系统性红斑狼疮和成人活动性狼疮性肾炎的药物。对于这种无法治愈的自身免疫性疾病的患者而言,这是一项重要的治疗进展。
2020-12-1850%晚期NSCLC患者可获长达4年生存期 度伐利尤单抗治疗显优异生存获益
在ESMO大会上发布的III期PACIFIC 试验数据也显示,约35%的非小细胞肺癌患者接受英飞凡治疗四年后仍未出现疾病进展。
2020-09-22拜瑞妥“新用途”在中国获批 用于冠状动脉疾病或外周动脉疾病患者
中国药品监督管理局批准拜耳拜瑞妥(利伐沙班片)与阿司匹林(ASA)联合给药,用于慢性冠状动脉疾病(CAD)或外周动脉疾病(PAD)患者,以降低主要心血管事件(心血管死亡、心肌梗死和卒中)风险。
2020-08-03首个非激素外用PDE-4抑制剂舒坦明在中国获批 用于轻中度特应性皮炎患者的治疗
中国国家药品监督管理局已正式批准辉瑞公司的舒坦明(克立硼罗)2%软膏剂的进口药品注册证。舒坦明在中国被批准用于2岁及以上轻度至中度特应性皮炎患者的局部外用治疗。
2020-08-03世界艾滋病大会公布新型HIV药物多拉韦林最新研究成果
2020年第23届世界艾滋病大会(AIDS)在新型HIV药物临床试验及安全性研究领域,公布了多个振奋人心的消息。关于新型非核苷逆转录酶抑制剂DELSTRIGO(多拉韦林/拉米夫定/替诺福韦)的临床试验DRIVE-SHIFT的最新结果显示 ,接受DELSTRIGO治疗的患者在治疗期间的体重变化与未感染HIV病毒的普通人群相似,其安全性得到进一步确认。
2020-07-14帕博利珠单抗获批食管癌治疗,中国食管癌免疫治疗正式开启
由于中西食管癌的差异,很多用于食管腺癌疗效不错的化疗或靶向药物,用于食管鳞癌却屡屡碰壁,以至于食管鳞癌近半个世纪以来没有新药上市,中国食管癌亟需可以改善长期生存获益的新药新疗法。
2020-06-23塞瑞替尼新添适应症,入局ALK阳性非小细胞肺癌一线治疗
近年来,肺癌在中国的发病率及死亡率位均列恶性肿瘤的第一位,高达85%以上的肺癌为非小细胞肺癌,其中的ALK阳性患者占NSCLC患者的3%-7%,在亚裔非吸烟的年轻人群中较为常见,被诊断时大都已处于疾病晚期。
2020-05-28奥拉帕利在美获批用于治疗HRR基因突变的转移性去势抵抗性前列腺癌
前列腺癌是男性中第二大常见癌症,尽管目前针对mCRPC患者的疗法数量有所增加,但患者的5年生存率仍然很低。HRR基因突变发生于约20-30%的mCRPC患者中。
2020-05-20礼来Retevmo获FDA批准成为首个针对RET驱动基因晚期肺癌和甲状腺癌患者疗法
Retevmo是一种口服选择性RET激酶抑制剂。Retevmo既作用于肿瘤细胞,也可影响正常细胞,这可能导致药物副反应的发生。
2020-05-14替雷利珠单抗注射液联合化疗治疗一线晚期鳞状非小细胞肺癌患者3期临床数据首次披露
伴随着以PD-1/PD-L1免疫检查点抑制剂为代表的免疫肿瘤治疗药物的出现,晚期鳞状NSCLC患者迎来了治疗的新希望。
2020-05-14诺华多发性硬化又一重磅创新药万立能(西尼莫德)中国获批
高达50-60%的复发缓解型(RRMS)患者将发展为活动性继发进展型多发性硬化(SPMS),万立能(西尼莫德)能有效减缓患者残疾进展和认知能力下降。
2020-05-09信迪利单抗联合吉西他滨和铂类一线治疗鳞状非小细胞肺癌,显著延长无进展生存期
研究显示,信迪利单抗联合吉西他滨和铂类对比安慰剂联合吉西他滨和铂类,显著延长了无进展生存期(PFS),达到预设的研究终点,PFS显著获益,安全性特征与既往报道的信迪利单抗研究结果一致,无新的安全性信号。
2020-05-07罗氏免疫治疗药物泰圣奇在华上市,打破小细胞肺癌治疗30年困局
着罗氏在中国正式进入肿瘤免疫治疗领域,中国的小细胞肺癌患者从此不再无药可医,打破30年“药荒”窘境。
2020-04-30诺华可善挺(司库奇尤单抗)强直性脊柱炎适应症获批
白介素-17A(IL-17A)是促进炎症级联反应、新骨生成、最终导致骨融合和完全强直的重要介质。作为目前全球首个且唯一全人源IL-17A抑制剂,可善挺可特异性阻断任何来源的IL-17A,有效控制炎症并抑制新骨形成,多层调控病理进展。
2020-04-28FDA批准克立硼罗软膏轻度至中度特应性皮炎儿童扩展适应症补充新药申请
克立硼罗是美国第一个,也是唯一一个被批准用于小至3月龄患者的100%非激素类的外用处方药
2020-04-28赛诺菲巴斯德四价脑膜炎球菌结合疫苗在美获批 为2岁及以上人群提供保护
MenQuadfi适用于更广泛的年龄组,并在多个年龄段人群中产生高免疫应答。MenQuadfi正在欧洲和其他国家接受监管审批,有望支持各地的免疫工作。
2020-04-27中国黑色素瘤双靶联合治疗方案开出首张处方,全国37个城市正式上市
黑色素瘤源于黑色素细胞的恶变,除宿主因素外,目前认为黑色素瘤可能与环境因素如紫外线照射,长期慢性损伤和不恰当处理等有关。我国黑色素瘤每年新发病例在2万例左右,肢端、黏膜型黑色素瘤是我国的常见的临床亚型。
2020-04-27ALK阳性肺癌克唑替尼耐药后新选择 首药控股CT-707获业内认可
研究数据表明:对于既往没有接受过ALK抑制剂治疗的ALK阳性晚期非小细胞肺癌患者,450mgQD剂量组的客观缓解率(ORR)为87.5%,疾病控制率(DCR)为100%;对于克唑替尼耐药的病人,300mgBID剂量组的ORR为83.3%,DCR为100%,疗效在同类药物中表现优异。
2020-04-26国家药品监督管理局受理胃肠道间质瘤精准靶向药avapritinib两个适应症上市申请
avapritinib获美国FDA批准上市后,仅三个月,基石药业即已在中国台湾和中国大陆分别递交了avapritinib新药上市申请,希望能尽快将这款药物带给大中华区患者
2020-04-24新研究:骨科非大手术后主要静脉血栓栓塞发生风险使用利伐沙班后可降75%
国际多中心,随机双盲PRONOMOS研究纳入3604名接受下肢骨科非大手术,且需要进行血栓预防至少两周的成年患者,在该患者群比较利伐沙班和依诺肝素起始治疗用于静脉血栓栓塞预防的疗效,1809名患者接受利伐沙班10mg每日一次,1795名患者根据医学判断(制动情况)皮下注射4000单位依诺肝素2周至12周。
2020-04-17阿柏西普与单抗的间接比较结果公布:两年内阿柏西普所需注射省六针
接受阿柏西普与雷珠单抗治疗延迟(T&E)方案的两组患者, 虽然视力获益相当, 但阿柏西普治疗组注射次数在两年内少六针, 具有统计学意义, 并且对患者具有实际临床意义
2020-04-10心衰在研新药Vericiguat达到III期临床首要终点
每日一次Vericiguat(最大剂量至10mg)与现有标准心衰治疗联合使用能够显著降低既往发生恶化事件的症状性慢性心衰(射血分数<45%)患者的心血管死亡和心衰住院复合终点,风险比为0.9(95% CI 0.82-0.98; p=0.019),绝对风险降低为4.2/100患者年。
2020-04-09阿斯利康度伐利尤单抗获FDA批准用于治疗广泛期小细胞肺癌
度伐利尤单抗联合标准治疗(SoC)铂+依托泊苷的化疗方案,延长了患者的总生存期(OS),具有显著的统计学差异和临床意义。
2020-03-31基石药业在台湾递交胃肠道间质瘤精准靶向药物avapritinib上市申请
Avapritinib已于2020年1月获美国FDA批准,是目前首个且唯一上市的GIST精准靶向药物,用于治疗PDGFRA外显子18突变的、不可手术切除或转移性GIST患者
2020-03-27豪森药业获批全球第二个三代EGFR-TKI创新药阿美乐(甲磺酸阿美替尼片)
对于EGFR敏感突变患者,目前主要使用第一/二代 EGFR-TKI靶向药物治疗,较传统化疗优势明显
2020-03-19喜达诺(乌司奴单抗)再获新适应症 成人克罗恩病治疗进入白介素新时代
喜达诺是国内获批的首个全人源“双靶向”白细胞介素12(IL-12)和白细胞介素23(IL-23)抑制剂,此次加速审批得益于国家药品监督管理局和国家卫生健康委员会于2019年5月29日将喜达诺纳入到第二批临床急需境外新药名单中。
2020-03-13诺华达拉非尼联合曲美替尼获批黑色素瘤辅助治疗,双靶治疗添新适应症
黑色素瘤是一类起源于黑色素细胞的高度恶性肿瘤,可发生于皮肤、肢端、黏膜(消化道、呼吸道和泌尿生殖道等)、眼葡萄膜、软脑膜等不同部位或组织。我国黑色素瘤的每年新发患者数约为2万人,发病率和死亡率皆呈逐年上升的趋势。其中,BRAF突变是黑色素瘤最常见的基因突变类型,每四位中国黑色素瘤患者中,就可能有一位是BRAF V600突变的患者。
2020-03-06默克西妥昔单抗添新适应症,获批一线治疗头颈部鳞癌
国家药品监督管理局(NMPA)批准西妥昔单抗注射液(爱必妥,Erbitux)与铂类和氟尿嘧啶化疗联合,用于一线治疗复发和/或转移性头颈部鳞状细胞癌(R/M SCCHN)
2020-03-03- 满3个疗程即获援助,O药援助项目升级,患者“更多获益”!
新年伊始,中国癌症基金会宣布调整O药患者援助方案,为符合条件的低收入肺癌和头颈部鳞癌患者送上新年好礼。新方案由原先的“6+7”调整为“首次3+3,后续3+4循环”,患者每轮自付比例下降50%,获得援助间隔期缩短,以“短平快”的模式减轻患者经济顾虑,让符合条件的患者不轻易放弃治疗,最大化免疫治疗效果。据了解,调整后的援助方案将于2020年2月起执行。
2020-01-07 我国首个自主创新13价肺炎球菌多糖结合疫苗沃安欣获批
肺炎球菌性疾病是全球疫苗可预防疾病中死亡人数和死亡占比最高的疾病,在中国,婴幼儿是侵袭性肺炎球菌性疾病的高危人群,每年死于肺炎球菌性疾病的5岁以下婴幼儿每年高达3万名。
2020-01-02肺癌创新药二代ALK抑制剂CT-707将上市
据石远凯教授介绍,CT-707的目标人群是ALK阳性的非小细胞肺癌患者(包括初治的和克唑替尼耐药/不耐受的病人)。基于I期临床试验的显著药效和良好的安全性数据,CT-707获得了国家药审中心批准的“II期有条件批准上市”资格,目前CT-707正在全国39家医院紧锣密鼓地开展注册性的II期临床研究。
2019-12-31用于治疗中重度斑块状银屑病成人患者的靶向白细胞介素23抑制剂特诺雅(古塞奇尤单抗)在华获批
作为中国获批的首个靶向针对白介素23(IL-23)的全人源化单克隆抗体,特诺雅长效持久的皮损清除效果已在三项全球III期研究(VOYAGE 1、VOYAGE 2和NAVIGATE)中得到证实。研究表明,在第16周,73%接受特诺雅治疗的患者,其皮损清除面积> 90%(PASI 90)。在第48周,76%接受特诺雅治疗的患者仍可维持PASI 90应答。另一项近期发表的III期头对头研究也证实,特诺雅在第48周达到PASI 90的患者比例显著高于司库奇尤单抗。
2019-12-30全程靶向治疗“从早到晚” 实现HER2阳性乳腺癌诊疗慢病化管理
对于有一些由于各种原因还是会发展成晚期的患者,应当注意尽早按照《指南》进行干预,以延长患者的寿命,提高其生活质量。
2019-12-30肿瘤免疫治疗新选择,百济神州PD-1替雷利珠单抗正式获批上市
肝癌(原发性肝癌,简称肝癌)是中国又一高发癌种,每年国内有超过30万人死于肝癌,占全球肝癌死亡人数的一半左右。
2019-12-28肢端肥大症治疗药物醋酸兰瑞肽缓释注射液(预充式)正式获批
肢端肥大症简称“肢大症”,是一种起病隐匿的慢性进展性内分泌疾病,患者就诊时病程可能已达数年甚至10年以上。
2019-12-24阿斯利康慢阻肺三联新药布地格福吸入气雾剂中国获批,显著降低急性加重率
2018年最新流调数据显示,我国慢阻肺患者总人数近1亿,40岁以上平均每7个人中就有一个慢阻肺患者。
2019-12-23Enhertu在美国获批用于治疗HER2阳性无法切除或转移性乳腺癌患者
Enhertu是一款针对HER2的抗体偶联药物(ADC),FDA的批准基于注册性II期临床试验DESTINY-Breast01的结果
2019-12-23狼疮性肾炎患者新希望,贝利尤单抗治疗狼疮性肾炎患者的III期临床试验新进展
研究显示,约40%的SLE患者在第1年出现器官损害,50%的患者发病5年内发生永久性器官损害,60-80%的SLE患者可有肾脏受累的临床征象,表现有蛋白尿、血尿,或伴肾功能不全(即狼疮性肾炎(LN))。
2019-12-20中国黑色素瘤治疗即将迎来双靶时代:泰菲乐和迈吉宁获批在中国上市
此次获批的泰菲乐和迈吉宁中,泰菲乐是一种强效和选择性BRAF激酶活性抑制剂。迈吉宁是一种可逆的、高选择性MEK1和MEK2激酶活性的变构抑制剂。两者联合治疗,针对BRAF V600突变阳性黑色素瘤的驱动突变靶点,可以使病灶得到快速且显著的缓解,并改善患者的无进展生存。多项全球关键性临床研究结果显示,对比靶向单药治疗,泰菲乐和迈吉宁联合使用可帮助BRAF V600突变黑色素瘤患者,得到更高的疾病缓解,实现更长的无进展生存。
2019-12-20临床急需,国内首个法布雷病特效药物法布赞在华获批
法布雷病(也叫法布里病)是一种罕见的X染色体伴性遗传的溶酶体贮积病,患者常常出现如手脚烧灼般的疼痛,短则持续数分钟,长则数日之久,有时反复出现,严重时无法正常生活,并对肾、心脏、脑、神经等各器官产生严重损害造成病变,如得不到有效治疗将严重威胁生命。这类疾病症状往往出现在患者儿童至青少年时期。
2019-12-20罗氏创新靶向药帕捷特又一适应症获批 开启HER2阳性晚期乳腺癌治疗新格局
如今,帕捷特HER2阳性晚期乳腺癌一线治疗适应症的获批已经是第三个在中国获批的适应症。
2019-12-10K药又获肺癌新适应症,食管癌已在路上
K药是不是最适合中国人的PD-1单抗,答案有待更多来自中国临床研究的数据揭晓。我们也期待K药能够在中国“本土化”上继续发力,惠及更多患者。
2019-12-04中国抗癌新药在美获批上市!泽布替尼,淋巴瘤治疗上的新突破
今天,美国FDA宣布批准了百济神州的BTK抑制剂泽布替尼Brukinsa(zanubrutinib)上市,用于治疗经治的成年套细胞淋巴瘤(MCL)患者。这是中国自主研发的抗癌疗法首次获得FDA的批准,是一次“零的突破”。
2019-11-15国内首个氨溴索雾化吸入剂易安平正式上市
由于雾化吸入疗法具有直接作用于靶器官、起效迅速,疗效佳、所需药物剂量小、全身不良反应少、无需患者刻意配合等优势,在呼吸系统疾病治疗中具有重要地位。
2019-10-30我国“全球首创”银屑病新药欣比克上市
银屑病常用的外用治疗主要包括糖皮质激素和维生素D3衍生物。中华医学会皮肤性病学分会主任委员陆前进教授介绍,糖皮质激素见效快、疗效好,但存在易反复的缺点,患者常常因为担心副作用而从心理上不太接受;维生素D3药物目前是治疗银屑病的一线外用药,是非激素外用药物的“金标准”。本维莫德乳膏作为我国自主研发的国家1类新药具有全新作用机理,能多通路抑制银屑病发病环节,它的上市将会给患者带来全新的疗效体验。
2019-10-20中国首个自主研发人源化抗CD25单克隆抗体开出首张处方
近年来,选择合理的免疫抑制剂方案,减少不良反应发生率,改善肾移植患者长期生存已成为新趋势,异源蛋白量更少的人源化抗体更是我国器官移植发展的需要。
2019-10-18美国FDA批准利伐沙班用于内科急重症患者预防血栓
每年美国有700多万人因内科急重症住院,这些患者出院三个月内的VTE发生风险较高,其中80%的事件发生在前六周。
2019-10-17首个肺癌一线免疫单药凭借中国数据国内获批上市,食管癌也在路上!
同样是胸部肿瘤的食管癌,中国患者的发病机制、病理、临床疗效和欧美差异较大,以鳞癌为主,而且中国食管癌患者大多发现晚、肿瘤负荷高,预后更差,急需找到疗效显著、安全性好的治疗方案。
2019-10-09吴一龙教授和周清教授深度解读ARTEMIS(CTONG1509)研究,A+T有望成为EGFRm+ NSCLC一线治疗新标准
中国肺癌治疗的探索从未止步,一直往更精准更高效的方向发展,始终为延长患者生存而努力。中国开展的III期CTONG1509研究,是A+T方案首次在中国EGFR突变的NSCLC患者得到印证的大型临床研究。A+T的应用为众多EGFRm+ NSCLC患者的一线治疗增加了选择,特别是为21外显子突变患者以及脑转移患者提供了更为精准的治疗方案,未来一定会对中国的临床实践产生重大的影响。
2019-10-08纳武利尤单抗对比化疗使晚期食管癌患者的死亡风险降低23%,中位总生存期延长2.5个月
与化疗相比,纳武利尤单抗的治疗相关不良事件(TRAEs)较少,接受纳武利尤单抗患者的总TRAEs发生率为66%,而化疗组患者达95%。纳武利尤单抗组的3-4级TRAEs发生率较化疗组更低(18% vs 63%),两组因TRAEs导致停药的患者比例相同(9%)
2019-10-01ESMO重磅!尼拉帕利一线维持治疗数据出炉,所有类型卵巢癌患者均获益
PRIMA研究,已在2019年ESMO年会presidentialsymposium上进行展示,并同步发表于《新英格兰杂志》,展示了尼拉帕利在所有研究对象中与安慰剂相比可以降低38%疾病进展或死亡风险;更重要的是,无论是存在HRD阳性或是HRD阴性的患者都展示了有临床和统计学意义的临床获益
2019-09-29打破半个世纪无药困境!帕博利珠单抗食管癌亚洲数据惊艳CSCO!
CSCO大会上公布的亚洲人群结果更是令人惊喜,数据显示,亚洲人群总生存延长更为显著:帕博利珠单抗组一年生存率达43.5%(其中PDL1高表达人群一年生存率达54.2%),对比标准化疗方案23.9%,意味着帕博利珠单抗治疗亚洲食管癌生存超过一年的患者是化疗组的两倍。
2019-09-23延缓前列腺癌转移 新一代雄激素受体抑制剂安森珂在华获批
过去十年,中国前列腺癌的发病率呈上升趋势,现已成为中国男性第五大常见癌症。如果前列腺癌患者接受雄激素剥夺疗法(ADT)后PSA水平上升,可能提示治疗效果下降或失效,患者可能进入去势抵抗阶段。
2019-09-10礼来银屑病新药拓咨(依奇珠单抗注射液)在华获批
2018年8月,国家药品监督管理局将拓咨(依奇珠单抗注射液)纳入48个境外已上市临床急需新药名单中。受益于此政策,其仅用了12个月便获批上市,使中国银屑病患者得以提前迎来新的治疗方案!
2019-09-05罗沙司他获批用于非透析患者肾性贫血治疗,全球首创新药扩大适用范围
罗沙司他是由阿斯利康和珐博进合作开发的全球首个口服低氧诱导因子脯氨酰羟化酶抑制剂(HIF-PHI)。作为首个全球同步研发,中国首发的1类新药,罗沙司他被列入我国“重大新药创制” 科技重大专项中。
2019-08-22罗氏旗下乳腺癌创新靶向药帕捷特又一适应症在中国获批
本次中国国家药品监督管理局批准帕捷特的新辅助适应症主要基于PEONY临床试验。该研究是第一个基于亚洲人群的新辅助双靶、随机、多中心、双盲、安慰剂对照的III期试验。
2019-08-21礼来男性健康产品希爱力(他达拉非片)新适应症正式上市
这是继ED按需治疗、每日一次治疗后,希爱力(他达拉非片)又一新增的适应症。该适应症的获批上市,将进一步满足男性健康领域的治疗需求,同时丰富男性疾病的治疗手段。
2019-08-12帕博利珠单抗成为全球首个食管癌PD-1获批药物,食管癌终于有了免疫治疗!
来自世界卫生组织(WHO)国际癌症研究机构(IARC)的《全球癌症报告》显示,仅2018一年,全球就有57.2万人新诊断为食管癌,同时又有50.9万人死于食管癌,其中一半以上的食管癌新发患者和死亡患者,都来自中国!
2019-08-02快速缓解口腔黏膜炎疼痛 新型口腔凝胶益普舒在中国上市
口腔黏膜炎是肿瘤患者放化疗常见的不良反应之一,可见于20%-40%的常规化疗、80%的大剂量化疗(如造血干细胞移植预处理)和大多数进行头颈部放疗的患者。口腔黏膜炎通常表现为红肿、糜烂、溃疡和疼痛,影响吞咽和进食,常导致化、放疗的剂量降低、中断或延迟,严重地影响患者的生活质量、治疗进度及疗效。
2019-07-22优时比创新药希敏佳获批 正式进军中国免疫系统疾病治疗领域
作为优时比引入中国的首款生物制剂,希敏佳的获批标志着优时比由此进入中国免疫系统疾病治疗领域
2019-07-22恒瑞获批国内首家阿比特龙仿制药 指南推荐提升患者获益
艾森特的生物等效性研究表明,其与原研药的质量和疗效基本一致。此外,它还能带来降低医疗支出、提高药品可及性,从而提升患者实际的治疗水平,实现经济效益和社会效益。
2019-07-11全球首个CD38单克隆抗体靶向药物兆珂在华获批
多发性骨髓瘤(Multiple Myeloma, MM)是一种不可治愈的血液系统恶性肿瘤,在我国的发病率已超过急性白血病,位居血液系统恶性肿瘤第二位。尽管近年来多发性骨髓瘤的治疗取得了诸多进展,但多数患者仍面临着复发或耐药的问题,复发和难治性多发性骨髓瘤困扰着临床医生,并威胁患者生命。
2019-07-09礼来类风湿关节炎新药艾乐明(巴瑞替尼片)在华获批
类风湿关节炎是一种慢性炎症性自身免疫性疾病,严重影响患者的日常工作和生活,从而影响患者的生活质量。近期的流行病学调查显示,中国大陆地区类风湿关节炎患病率0.28%,总患病人群约500万,男女患病比率约为1:4。
2019-07-01饿“晕”癌王!抗血管生成靶向药,开启脑癌治疗新格局
延缓病情进展,保持生活质量,两大优势让安维汀+洛莫司汀的联合治疗方案,被列入了美国NCCN、欧洲EANO/ESMO等多个权威的胶质母细胞瘤治疗指南,作为复发性胶质母细胞瘤患者的常用,甚至是首选疗法。
2019-06-11西安杨森每三月皮下注射一次治疗银屑病生物制剂喜达诺上市
PHOENIX延长扩展研究显示,喜达诺 可长期维持银屑病临床治疗反应,随着喜达诺治疗时间的延长,未观察到剂量相关或累积的毒性。真实世界PSOLAR研究8年间共纳入了超过12000名使用喜达诺和其他治疗方案的患者数据,该研究结果与喜达诺总体安全性相一致。此外, 多个真实世界注册研究显示,与纳入研究中的其它生物制剂相比,喜达诺的总体药物留存率更高,停药风险更低。
2019-06-06亚盛医药公布细胞凋亡系列临床产品APG-115、APG-1387最新临床数据
亚盛医药此次公布的其中两项数据是关于MDM2-P53抑制剂APG-115分别在中国、美国的临床进展,另外一项研究是关于新靶点IAP抑制剂APG-1387作为单药治疗、联合单抗药物治疗晚期实体肿瘤的I期研究。
2019-06-05胰腺癌和卵巢癌治疗迎突破 ASCO 2019公布奥拉帕利最新研究进展
对照化疗组,奥拉帕利的客观缓解率(ORR)具有统计学意义和临床意义改善,安全性和耐受性与先前研究一致。
2019-06-05百时美施贵宝在2019ASCO年会上首次发布纳武利尤单抗联合伊匹木单抗治疗晚期肝细胞癌的临床研究结果
纳武利尤单抗联合伊匹木单抗的客观缓解率达31%,中位缓解持续时间为17.5个月;数据显示了免疫肿瘤(I-O)联合治疗方案在全球第四大致死癌症肝癌中的治疗潜力
2019-06-03曾小峰:推进尼达尼布治疗硬化病相关的间质性肺疾病(SSc-ILD)审批,将为患者带来曙光
尼达尼布治疗SSc-ILD的SENSCIS研究结果已经于5月20日在新英格兰杂志发表,并于2019年美国胸科协会年会上公布。
2019-06-01安进宣布首个骨巨细胞瘤治疗药物安加维地舒单抗在中国获批
骨巨细胞瘤是一种组织学上良性,但常常具有侵袭性的骨骼肿瘤,好发于20~40岁青壮年人群,女性发病率略高于男性,约占56.4%。从全球来看,骨巨细胞瘤约占所有骨原发肿瘤的4%-5%,与欧美人群相比,在中国更为常见,约占所有原发骨肿瘤的20%。尽管绝大多数骨巨细胞瘤为良性肿瘤,但若不进行治疗,经常引起受影响的骨骼完全损坏,导致骨折、关节功能障碍或截肢。
2019-05-27突破性创新型抗生素——辉瑞思福妥 (注射用头孢他啶阿维巴坦钠)在中国获批
新型抗生素思福妥 ZAVICEFTA(注射用头孢他啶阿维巴坦钠2.5g),已于2019年5月21日获得国家药品监督管理局(NMPA)批准,用于治疗复杂性腹腔内感染(cIAI)、医院获得性肺炎(HAP)和呼吸机相关性肺炎(VAP)、在治疗方案选择有限的成人患者中治疗由下列对本品敏感的革兰阴性菌引起的感染:肺炎克雷伯菌、阴沟肠杆菌、大肠埃希菌、奇异变形杆菌和铜绿假单胞菌。
2019-05-27达霏欣新品在京隆重发布 倡导脱发需”男女分治”
达霏欣首次提出“OK线”概念——将大拇指和食指连成圈状,中指、无名指、小拇指三指并拢,形如“OK”的手势,手心朝外,食指保持水平垂直贴近额头,以眉毛的水平高度为起点,能完整填充于眉毛与发际线之间,说明发际线高度达到OK标准,未达到标准的,说明你的发际线过高或过低,发际线过高的原因很可能就是脱发。
2019-05-24拜耳治疗子宫内膜异位症新药唯散宁获批上市
子宫内膜异位症是子宫内膜生长在宫腔以外的部位。这种异位的组织也随月经周期而出血脱落。子宫内膜异位的常见部位是卵巢、子宫肌层和子宫周边组织。大约有5%到10%育龄女性受此状况影响。子宫内膜异位症可导致渐进性痛经,慢性盆腔痛及性交痛等不同种类的疼痛,有时甚至是重度疼痛;还可能影响生育力。
2019-05-15拜耳艾力雅治疗间期可延至3个月,其新治疗方案在中国获批
新的治疗方案延长了新生血管(湿性)年龄相关性黄斑变性(nAMD)患者第一年的用药间隔,并使其获得了很好的视力预后,ALTAIR 研究证实:57%采取新治疗方案的患者可使患者维持视力获益的时间延长至12周或更长时间。
2019-05-08百济神州在研创新型BTK抑制剂定中文通用名为“泽布替尼”
泽布替尼(zanubrutinib,BGB-3111)诞生于百济神州位于北京昌平生命科学园的研发中心,由百济神州的中国科学家团队独立研发,这款新型BTK抑制剂的药物设计旨在最大化对BTK靶点的特异性结合率,同时最大程度地减少脱靶效应。
2019-04-24拜耳磁共振对比剂加乐显(钆布醇注射液)2岁以下儿童适应症在华获批
国内唯一适用于全年龄段全身检查的大环状磁共振对比剂,包括足月新生儿,填补了儿童(0-18岁)磁共振血管造影(CE-MRA)大环状磁共振对比剂的用药空白。
2019-04-16新一代造血干细胞动员剂释倍灵开出中国首张处方
如果把骨髓想象成一个生产造血干细胞的工厂,不使用动员方案,工厂的生产只是正常水平,只能有微弱的造血干细胞游离到外周血;而使用动员剂后,就可以让骨髓内的造血干细胞进行加速生产并溢出到外周血,这样就有机会收集到足够数量的造血干细胞。
2019-04-16吃1片管5天!20年来全球首款全新机制抗流感病毒药
按照作用机制的不同,抗流感病毒药物可以分为三类:金刚烷类、神经氨酸酶抑制剂和CAP依赖性核酸内切酶抑制剂。其中金刚烷类上市最早,但因为广泛耐药已经不再推荐用于治疗或预防流感。
2019-04-09诺华全球重磅产品可善挺(司库奇尤单抗)在华获批2019-04-01
中国创新PD-1抑制剂达伯舒(信迪利单抗注射液)正式登陆国内市场
达伯舒(信迪利单抗注射液)注册临床试验的主要研究者(PI)、中国医学科学院肿瘤医院副院长石远凯教授在会上分享了该临床试验数据。该临床试验受到了国际学术界的高度关注和认可,相关结果还登上了国际权威医学期刊《柳叶刀 血液学》,这对中国创新生物药而言意义非凡。
2019-02-23特应性皮炎靶向生物制剂Dupixent中国内地首针注射完成
可应用该生物制剂的患者应符合四个基本条件:血清免疫球蛋白E (IgE)指标增高、嗜酸性粒细胞增高、皮肤屏障受到破坏、临床上其他药物无效。这四个条件均符合后,再进行全身评估,符合症状的患者可进行治疗。
2019-02-22迅速缓解口腔黏膜炎疼痛 新型口腔凝胶益普舒获批上市
口腔黏膜炎是临床上常见的不良反应,可见于20%-40%的常规化疗、80%的大剂量化疗(如造血干细胞移植预处理)和大多数进行头颈部放疗的患者。口腔黏膜炎通常表现为红肿、糜烂、溃疡和疼痛,影响吞咽和进食,常导致化、放疗的剂量降低、中断或延迟,甚至需要住院处理,严重地影响患者的生活质量、治疗进度及疗效。
2019-02-21中国首个鸟苷酸环化酶激动剂令泽舒(利那洛肽)正式获批
作为我国专门治疗成人便秘型肠易激综合征(IBS-C)的处方药物,令泽舒的获批将填补我国成人便秘型肠易激综合征的治疗空白,为广大国内患者带来福音。利那洛肽在美国等全球30多个国家获批上市。目前,利那洛肽已成为全球治疗便秘型肠易激综合征的领先处方药。
2019-01-15持续推动血友病治疗领域发展 拜耳新型重组八因子科跃奇上市
全世界约有40万血友病人,且在很大程度上为一种遗传性疾病,而在该遗传性疾病中,形成血凝块所需要的其中一种蛋白质缺失或减少。因子Ⅷ缺失或减少的A型血友病是最常见的血友病类型,目前,A型血友病发病率为每5000名存活男婴中有1例患病。A型血友病可能导致出血时间延长或自发性出血,特别是发生在关节、肌肉或内部器官,长期可导致患者残疾。
2019-01-14罗氏旗下乳腺癌创新靶向药帕捷特在中国获批
罗氏制药宣布,旗下乳腺癌创新靶向药帕捷特(英文商品名: Perjeta,通用名:帕妥珠单抗)已获得中国国家药品监督管理局批准,联合曲妥珠单抗和化疗,用于高复发风险的 HER2 阳性早期乳腺癌患者的辅助治疗。
2018-12-18西安杨森泽珂在中国新适应症获批 用于治疗新诊断的高危转移性内分泌治疗敏感性前列腺癌
新适应症的获批基于一项国际多中心、随机、双盲、对照3期临床研究LATITUDE得出的结果。该试验涉及1199位新诊断的高危mHSPC患者,包括137位中国患者。所有患者入组之前未接受内分泌治疗,或接受内分泌治疗不超过3个月。这些患者被随机分为两组,试验组的治疗方案为阿比特龙与泼尼松和ADT(雄激素剥夺治疗,ADT)联用(简称阿比特龙组),对照组为ADT加安慰剂(简称ADT组)。
2018-12-12创新PD-1首登国际学术会议舞台自主研发惠及“中国式”肝癌
中国男性的肝癌发病率在所有恶性肿瘤中排第三位,而女性排在了第六位。其中乙型肝炎(HBV)患者在中国的原发性肝癌患者中占据了80%以上。“乙型肝炎-肝硬化-肝癌”的发展过程被称为肝癌三部曲,很多患者和医生对其并不陌生,因此研究并发现针对携带乙型肝炎登肝癌治疗方法在中国显得尤为重要。
2018-11-13突破!晚期霍奇金淋巴瘤有了免疫治疗方案
最近一项由中国医生领衔的复发难治性经典型霍奇金淋巴瘤免疫治疗方案,或将改变晚期患者无药可用的窘境,为他们带来“续命的春天”。
2018-11-12EMPRISE真实世界研究初步结果显示 恩格列净能降低患者的心衰住院风险
EMPA-REG OUTCOME试验结果显示,对于确诊合并心血管疾病的2型糖尿病患者,在标准治疗的基础上,恩格列净与安慰剂相比能将患者的心衰住院相对风险降低35%。心衰住院风险是EMPA-REG OUTCOME试验的一项次要终点。
2018-11-09《新英格兰医学杂志》发表Praluent(alirocumab) 心血管结局研究的详细结果
Praluent使主要不良心血管事件(MACE)显著减少15%(P<0.001);Praluent与全因死亡风险降低15%相关 (风险比[HR]0.85; 95%可信区间[CI]):0.73~0.98);该研究其他相关分析结果(如死亡率)将在2018年11月10日至12日即将举行的美国心脏学会(AHA)年会上公布
2018-11-08度拉糖肽针对广泛人群2型糖尿病患者心血管事件减少显示优效
核心提示:REWIND研究中,基线时确诊心血管疾病患者仅有31%
2018-11-06一日一贴缓解帕金森 优时比创新疗法在中国上市
优普洛是一款治疗帕金森病的透皮贴剂,于今年6月获得国家药品监督管理局批准,用于单药治疗(不与左旋多巴联用)早期特发性帕金森病症状及体征,或联合左旋多巴用于病程中各个阶段的治疗。
2018-11-05赛诺菲又一儿童创新药物法舒克在华获批
中国国家药品监督管理局批准法舒克(注射用拉布立海)用于儿童白血病、淋巴瘤患者的尿酸水平控制,儿童血液肿瘤患者在化疗过程中,需要高度注意高尿酸血症的预防和治疗,临床试验显示,法舒克用药4小时后,92%的患者尿酸水平降至正常水平。
2018-10-29再鼎医药宣布则在香港获批,用于复发性卵巢癌的治疗
ZL-2306 (Niraparib)是一种高效、选择性的每日一次口服小分子聚(ADP-核糖)PARP 1/2抑制剂。Niraparib已于2017年3月在美国获批,同年11月在欧洲获批,用于维持治疗对含铂化疗完全或部分缓解的复发性上皮卵巢癌、输卵管癌或原发性腹膜癌患者。
2018-10-25乐瑞卡新适应症在华获批上市 填补纤维肌痛治疗空白
国家药品监督管理局(SDA)已正式批准辉瑞公司的全新一代钙离子通道调节剂——乐瑞卡(普瑞巴林)纤维肌痛适应症的上市申请。由此乐瑞卡也成为目前在华领先获批上市的纤维肌痛治疗药物,填补了我国该疾病领域治疗的空白,在为我国纤维肌痛临床治疗提供用药依据的同时,也有利于提高我国患者及临床医生的疾病认知程度。
2018-10-15FDA批准拜耳利伐沙班用于冠状动脉疾病或外周动脉疾病患者
美国食品药品监督管理局的批准是基于III期COMPASS临床试验数据,结果表明:与单独使用阿司匹林100mg一天一次相比,利伐沙班动脉剂量2.5mg一天两次加阿司匹林100mg一天一次能够显著降低冠状动脉疾病或外周动脉疾病患者的卒中、心血管死亡和心肌梗死的复合风险达24%(相对风险降低)。
2018-10-12门静脉高压相关性肺动脉高压(PoPH)首个随机对照试验显示傲朴舒(马昔腾坦)与安慰剂相比显著改善肺血管阻力
PORTICO试验表明,马昔腾坦在门静脉高压相关性肺动脉高压(PoPH)患者中的安全性,包括肝脏安全性,与先前临床试验中观察到的结果一致。
2018-09-29中国甲状腺癌领域首项多中心真实世界研究结果公布
与其他肿瘤相比,分化型甲状腺癌预后较好,生存时间较长,容易使人忽略甲状腺癌治疗的重要性。四川大学华西医院甲状腺外科主任朱精强教授表示,乳头状癌的争议本质是微小癌,即小于10 mm的肿瘤。“体积再小,它的本质依然是癌,微小癌具有所有大于10 mm肿瘤的特征,例如淋巴结转移、大脑转移、肺部浸润甚至导致死亡。因此,认为微小癌代表低危,对人体没有伤害,这是错误的。”
2018-09-25达格列净被证实安全性良好有效降低心衰住院与心血管死亡风险
在DECLARE-TIMI 58心血管预后研究中,达格列净达到了主要心血管不良事件(MACE)非劣效性的主要安全终点;同时,达格列净显著降低了心力衰竭(hHF)或心血管死亡的住院复合终点,这也是两个主要疗效终点之一。达格列净组还观察到主要心血管不良事件(MACE)降低,但尚未显示出统计学显著差异。
2018-09-25手足口病无药可治困局有望破解,全球首个治疗药苏拉明钠临床启动研讨会召开
手足口病,危害中国儿童健康的高发传染病,然而,目前该病在全球范围内尚无针对性治疗药物。国际上针对肠道病毒没有特异抗病毒药,以支持和对症治疗为主。这种局面有望得到破解——康芝药业研发的儿童手足口病专用抗病毒药物注射用苏拉明钠已获得临床试验批件,如临床试验成功并获许生产,苏拉明钠将成为全球首个治疗手足口病的新药。
2018-09-25亚盛医药用于治疗格列卫耐药CML的原创1类新药HQP1351临床I期结果首发 为国内首个第三代BCR-ABL抑制剂2018-09-19
拜耳利伐沙班获欧盟批准用于冠状动脉疾病或外周动脉疾病患者
欧盟委员会已经批准利伐沙班的新适应症:利伐沙班2.5 mg一天两次联合阿司匹林75-100mg一天一次用于高缺血风险的冠状动脉疾病或者症状性外周动脉疾病成人患者,以预防动脉粥样硬化血栓性事件发生,将首先在德国上市。欧盟对该新适应症的批准是基于III期COMPASS临床试验数据,结果表明:与单独使用阿司匹林100mg一天一次相比,利伐沙班动脉剂量2.5mg一天两次加阿司匹林100mg一天一次能够显著降低冠状动脉疾病或外周动脉疾病患者的卒中、心血管死亡和心肌梗死的复合风险达24%(相对风险降低)。
2018-08-25百时美施贵宝欧狄沃三季度即将登陆中国
继6月15日获国家药品监督管理局批准后,欧狄沃(纳武利尤单抗注射液,nivolumab injection) 将于今年第三季度正式登陆中国市场,用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
2018-08-12一次检测多个基因 中国首个肿瘤多基因二代测序检测试剂盒获批上市
中国首个基于高通量测序技术(NGS)以及伴随诊断标准审批的多基因肿瘤突变联合检测试剂盒正式上市。与传统基因检测手段相比,通过二代测序技术,患者只需经过一次检测,即可同时了解多个肿瘤治疗相关基因的全部敏感突变位点状态,帮助选择最合适的治疗方案。
2018-08-04中国首个泛基因型HCV单一片剂丙通沙正式上市
吉利德科学公司在发布会上宣布,今年5月30日获批的慢性丙肝新药丙通沙(索磷布韦/维帕他韦)正式上市。丙通沙是中国首个通过审批的泛基因型丙肝病毒(HCV)单一片剂方案,可用于治疗基因1-6型、混合型及未知型慢性HCV的成人感染患者。
2018-08-01赛诺菲旗下多发性硬化口服治疗药物奥巴捷在华获批
多发性硬化是一种终身、慢性、进展性疾病,由于自身免疫系统的病变,引起神经髓鞘的破损和剥落,致使脊髓、大脑以及视神经功能受到损害,患者的神经系统残疾逐渐加重,丧失自理能力、失明甚至失去生命。多发性硬化好发于20-40岁中青年群体,女性患者大约是男性患者的1.5-2倍。目前,全球有超过230万人患多发性硬化,发病率约为0.03%。欧美国家患病率比亚洲人群高。
2018-07-26西安杨森旗下亿珂 获批适应症扩展
亿珂(伊布替尼胶囊)扩展适应症获批,用于慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者的一线治疗。2017年8月,亿珂在中国获批用于既往至少接受过一种治疗的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者以及既往至少接受过一种治疗的套细胞淋巴瘤患者的治疗。CLL/SLL一线治疗适应症的申请获得了国家药品监督管理局授予的“优先审批”资格,其获批使亿珂成为国内首个CLL/SLL一线治疗的口服靶向疗法,可以帮助更多患者更早地获益于这一创新疗法,从而提高生活质量。
2018-07-26我省丙肝基因1b型患者超40%,专家建议先检测再治疗
虽然丙肝治疗有了更多选择,但在开展丙肝治疗时,仍然需要综合患者感染的丙肝病毒特征、个体情况等综合因素,对患者进行精准治疗,才能达到理想的治疗效果。目前,已知的丙肝病毒主要有6个基因型和多个亚型,我国的丙肝患者约有56.8%1是基因1b型,而在广东省主要是1b型和6A型,其中基因1b型大概占比在40%左右。
2018-07-26国内首个ITP口服TPO-RA药物上市 开创迅速升板治疗新时代
首个也是唯一获批的非肽类口服血小板生成素受体激动剂(TPO-RA)瑞弗兰(通用名:艾曲泊帕乙醇胺片)正式在中国上市,将用于治疗经糖皮质激素类药物、免疫球蛋白治疗无效或脾切除术后慢性原发免疫性血小板减少症(ITP)患者的血小板减少。
2018-07-24默克联合西安杨森推降糖新药:把糖“尿”出去!
怡可安(卡格列净)借助全新的非胰岛素依赖作用机制,通过高选择性地抑制SGLT-2,进而减少肾脏对滤过葡萄糖的重吸收,降低肾糖阈,增加尿糖排泄,从而降低2型糖尿病患者的血糖。除了明确的降糖效果,它还可以降低体重、延缓蛋白尿进展和血压下降等额外获益。怡可安(卡格列净)的推出,是默克继格华止 (盐酸二甲双胍)和其他糖尿病产品之后的又一创新糖尿病治疗药物。
2018-07-13创新药物闪耀CNPDW 新药新疗法推动治疗目标更新
随着中国人口老龄化的加剧,以及工业化、城镇化、生态环境及生活方式变化等,抑郁症、帕金森病、阿尔茨海默病等神经和精神疾病的诊治依然存在大量未满足的医疗需求。与会专家认为:随着神经和精神疾病领域创新药物的上市,新药所带来的创新治疗方案不仅有助于让患者更快受益,也有助于整体提升我国神经和精神疾病的治疗水平。
2018-06-27全球首个手足口病治疗药物获美国专利授权
6月26日,国内知名儿童药上市企业康芝药业发布《关于公司取得美国专利证书的公告》。公告显示,公司于近日收到美国专利商标局颁发的专利证书一份。该专利首次揭示了一种P2X受体拮抗剂的新用途,用于发挥预防或治疗手足口病的作用。
2018-06-27眼底黄斑类疾病再出克星 患者获更优选择
全球约有2.85亿人视力受损,其中2.46亿人患有低视力(严重或中度视力障碍);糖尿病性黄斑水肿(DME)是发达国家工作年龄人群失明的主要原因;年龄相关性黄斑水肿(AMD)是导致视力下降的第三主要原因,也是发达国家排名第一的未被治疗疾病。
2018-06-03III期试验证实,Imfinzi 显著延长非小细胞肺癌患者总生存期
由独立数据监测委员会进行的预设中期分析显示,PACIFIC 试验达到了第二个主要研究终点。与安慰剂相比,接受Imfinzi治疗的患者,总体生存期延长达到显著的统计学差异和临床获益。Imfinzi的安全性和耐受性特征与之前报道无进展生存期(PFS)结果时的分析一致。阿斯利康计划在即将召开的学术会议上报道PACIFIC试验的生存期结果。
2018-06-03吉利德3代丙通沙(索磷布韦/维帕他韦)通过国家药品监督管理局审批
“丙通沙的安全性和有效性已被大量的临床试验和真实世界的数据证实,”北京大学人民医院肝病研究所魏来教授说,“由于丙通沙对所有基因型的丙肝患者都有高治愈率,我们在治疗时有望免除基因分型的检测,这对扩大丙肝治疗有积极意义。”
2018-05-31中国首个一周一次降糖药上市 开启中国糖尿病的周治疗时代
根据2017年发表在JAMA杂志的中国糖尿病患者流行病学调查数据显示,接受降糖治疗的患者中,血糖达标的患者仅49.2%。血糖控制不佳的原因有很多,高频次的给药方式极大地降低患者用药依从性,是造成血糖结局差的关键因素之一。因此尽可能地减少每日给药次数,降低糖尿病患者用药负担,已成为当前临床工作者解决血糖达标率低的重要考虑因素。
2018-05-30善妥达获批用于精神分裂症治疗
强生公司在华制药子公司西安杨森制药有限公司于5月25日宣布,国家药品监督管理局已于近日批准将善妥达®(棕榈帕利哌酮酯注射液(3个月剂型)),用于接受过善思达®(棕榈酸帕利哌酮注射液(1个月剂型))至少4个月充分治疗的精神分裂症患者。
2018-05-2818年磨一剑 国产乙肝新药“乐复能”宣布在全球上市
刘龙斌在介绍“乐复能”的研制情况时表示,“乐复能”的研究整整持续了18年,杰华人也整整坚持了18年。这期间,有过痛苦,有过彷徨,但从未放弃研究新药的梦想。天道酬勤,执着的坚持不仅迎来了今天“乐复能”成功的喜悦,也迎来了中国新药创新的春天来临。
2018-05-26默沙东慢性丙肝口服抗病毒药物艾尔巴韦格拉瑞韦片在华获批
默沙东公司(在美国与加拿大称为默克)2018年5月8日宣布,其慢性丙型肝炎口服直接抗病毒药物(Direct-acting Antiviral,以下简称DAA)艾尔巴韦格拉瑞韦片固定剂量复方制剂于2018年4月28日获得国家药品监督管理局(原国家食品药品监督管理总局)的上市批准,适用于治疗基因1、4型慢性丙肝的成年患者。
2018-05-10拜耳公司艾力雅(阿柏西普眼内注射溶液)获得国家药品监督管理局批准用于治疗成人新生血管(湿性)年龄相关性黄斑变性(nAMD)
国家药品监督管理局已批准艾力雅(阿柏西普眼内注射溶液)用于治疗成人新生血管(湿性)年龄相关性黄斑变性(nAMD)。 国家药品监督管理局药品审评中心(CDE)于2017年6月将该上市申请纳入优先审评程序。
2018-05-10全面改善抑郁症状 灵北创新型抗抑郁药心达悦中国上市
全球范围内,抑郁症被列为非致命健康损失的最大“贡献者”之一,占所有“总伤残损失健康生命年”的7.5%。中国是全球抑郁症疾病负担较为严重的国家之一。据世界卫生组织(WHO)的报告,中国有超过5400万人患有抑郁症,占总人口的4.2%,而全人群患病率约为4.4%。
2018-04-23抗击矮小症 原研进口的生长激素诺泽在中国正式上市
我国现有矮小人口3900万,4-15岁需要治疗的患儿数量约700万,然而每年就诊的人数不到30万名,真正接受治疗的患者不到3万名,治疗率不足1%。
2018-04-04替格瑞洛60 mg上市 助力高危心梗后人群全程保护
国家食品药品监督管理总局(CFDA)已正式批准替格瑞洛(倍林达)用于心梗后高危患者1年以上持续治疗的适应症,并批准替格瑞洛60 mg在中国的上市申请。
2018-03-24ODYSSEYOUTCOMES研究达到主要终点
ODYSSEYOUTCOMES研究达到了主要终点。研究结果表明:与单独使用最大耐受剂量他汀类药物相比,接受最大耐受剂量他汀基础上合用Praluent(alirocumab)的心血管高危患者的主要不良心血管事件明显减少。
2018-03-15被证能降低心血管死亡风险38%的降糖药——欧唐静在中国上市
自2008年美国FDA发布2型糖尿病治疗药物的心血管风险评估指南以来,大量心血管结局研究相继开展,但多未显示出心血管获益。可喜的是,EMPA-REG OUTCOME研究发现,在2型糖尿病合并心血管疾病的患者中,欧唐静显著降低心血管死亡风险达38%。
2018-03-07灵北创新型抗抑郁药心达悦(氢溴酸伏硫西汀片)获CFDA批准
2017年11月21日,由丹麦灵北公司研发的,用于治疗成人抑郁症的创新药物心达悦(氢溴酸伏硫西汀片)正式获得国家食品药品监督管理总局(CFDA)的上市批准。
2017-12-05艾尔建突破性眼科新药傲迪适(Ozurdex)获上市批准
2017年10月21日,全球制药行业的全新典范——增长型制药公司艾尔建(NYSE: AGN)宣布其眼科新药傲迪适Ozurdex(地塞米松玻璃体内植入剂)获中国国家食品药品监督管理总局(CFDA)上市批准。傲迪适Ozurdex为成年患者中由视网膜分支静脉阻塞(BRVO)或视网膜中央静脉阻塞(CRVO)引起的黄斑水肿病症带来了一种突破性的治疗手段,为该适应症在我国获得批准的首个玻璃体腔给药药品。
2017-10-23美国FDA授予Lynparza治疗转移性乳腺癌优先审评资格
2017年10月18日,阿斯利康公司与默沙东公司联合宣布,美国食品药品监督管理局(FDA)已受理Lynparza(奥拉帕利)片剂的补充新药申请(sNDA),用于治疗生殖系BRCA基因突变(gBRCAm)、HER2阴性的转移性乳腺癌,且患者之前接受过包括新辅助、辅助或者针对转移性乳腺癌的化疗。该项申请已被授予优先审评资格,预计将于2018年第一季度获得批准。
2017-10-23首个治疗肺栓塞的新型口服抗凝药拜瑞妥在华上市
数据显示:在发病1~2个小时内每4个肺栓塞中就会有1例死亡,即使度过危险期,患者依然存在致死性肺栓塞的复发风险,需要长期使用抗凝药物。
2017-10-16CFDA批准三生制药单克隆抗体新药临床试验
中国领先的生物制药公司三生制药(01530.HK)今天宣布,由集团开发的重组人源化抗血管内皮细胞生长因子(VEGF)单克隆抗体注射液,已获中国国家食品药品监督管理总局出具的新药临床试验申请批件,目前集团正积极准备该产品的临床试验。
2017-10-12多款丙肝新药在华上市 四大维度助选治疗方案
去年4月,国内外7家药企的12个丙肝药品被国家食药总局药品审批中心(CDE)纳入优先审批程序。一年之后,丙肝新药获批上市大幕正式拉开,包括艾伯维维建乐®(奥比帕利片)联合易奇瑞®(达塞布韦钠片)治疗方案在内的多款丙肝新药获批。
2017-10-11美国FDA授予泰瑞沙用于一线治疗EGFR突变阳性非小细胞肺癌患者的突破性疗法称号
2017年10月9日,阿斯利康公司宣布,美国食品药品监督管理局(FDA)授予泰瑞沙(奥希替尼)用于一线治疗EGFR突变阳性非小细胞肺癌(NSCLC)患者的“突破性疗法”称号。
2017-10-10能降低心血管死亡风险的糖尿病新药欧唐静在中国获批
2017年9月27日,勃林格殷格翰-礼来糖尿病联盟宣布,新一代的口服钠-葡萄糖共转运体2(SGLT2)抑制剂——欧唐静(通用名:恩格列净)已获得国家食品药品监督管理局的批准在中国大陆上市,该药可单药、联合二甲双胍或联合二甲双胍和磺脲类药物,用于改善2型糖尿病患者的血糖控制。
2017-10-09首个超长效基础胰岛素类似物诺和达 (德谷胰岛素注射液)在中国获得上市批准
德谷胰岛素具有超长效作用时间,不仅可以有效降低血糖,同时降低了低血糖发生率。德谷胰岛素在每日一次给药的前提下能提供更灵活的注射时间选择,解决现有基础胰岛素需要在每日固定时间内注射的困扰,为广大中国患者提供更优质治疗方案。
2017-09-29阿斯利康在2017欧洲肿瘤内科学会年会公布PACIFIC 试验结果:IMFINZI可显著延长无法手术切除的局部晚期肺癌患者的无疾病进展生存期
与标准治疗相比,Imfinzi 延长无疾病进展生存超过 11 个月,成为为这类患者人群带来显著 PFS 获益的首个药品;Imfinzi用于治疗无法手术切除的局部晚期肺癌继获得 FDA突破性疗法称号后,数据在 2017 年 ESMO 大会进行公布;PACIFIC试验将继续评估另一个首要研究终点总生存期。
2017-09-092017欧洲肿瘤内科学会年会:阿斯利康泰瑞沙有望成为EGFR突变阳性肺癌一线治疗新标准
三期临床试验FLAURA 结果表明奥希替尼可降低一半以上疾病进展或死亡风险,所有亚组获益一致,包括患者是否存在脑转移;与标准治疗组10.2个月的中位无进展生存期相比,奥希替尼组中位无进展生存期达到前所未有的 18.9 个月;初步观察到具有临床意义的总生存获益。
2017-09-09眼内抗新生血管药物首进医保 患者经济负担降八成
陈有信教授谈到:出于基金管理的目的,医保目录对一些眼内抗新生血管药物在使用条件和数量上进行了限定:以雷珠单抗为例,每眼累计最多支付9支,每个年度最多支付4支。
2017-09-07首个儿童抗乙肝病毒药在中国获批!
这是中国首个被批准用于小龄儿童(<12岁)乙肝患者的核苷类药物,有望给更多被乙肝病毒“肝扰”的患儿“信心的力量”,使他们可以与其他同龄人一样轻松地生活。
2017-08-17首个全口服直接抗丙肝病毒治疗方案 —— 百立泽联合速维普正式在中国上市
百时美施贵宝公司7月26日宣布,继4月24日获得国家食品药品监督管理总局(CFDA)批准后,用于治疗成人基因1b型慢性丙型肝炎(非肝硬化或代偿期肝硬化)的治疗方案——百立泽(盐酸达拉他韦片)联合速维普(阿舒瑞韦软胶囊)于7月初正式登陆中国市场。
2017-07-28首个全口服直接抗丙肝病毒治疗方案在中国上市
继4月24日获得国家食品药品监督管理总局(CFDA)批准后,用于治疗成人基因1b型慢性丙型肝炎(非肝硬化或代偿期肝硬化)的治疗方案——百立泽(盐酸达拉他韦片)联合速维普(阿舒瑞韦软胶囊)于7月初正式登陆中国市场。
2017-07-27欣维可 交联玻璃酸钠注射液正式登陆中国市场
欣维可 1997年起就在美国获准上市销售,20年来应用范围已遍及世界多个国家,目前已有超过1,500万个膝关节治疗的经验,其独特交联工艺,一个疗程仅需 3 针注射,便可轻松为受损膝关节提供持久保护。
2017-07-11罗氏VENTANA PD-L1(SP263)检测获得CE认证批准将其适应症扩展至辅助肺癌患者KEYTRUDA(pembrolizumab)免疫疗法的治疗决策
肺癌仍然是癌症死亡的主要原因,全球有近160万人死于肺癌,PD-L1是一种参与免疫系统抑制的蛋白,可影响人体抵抗癌症的能力,VENTANA PD-L1(SP263)检测1现已在认可CE标识的国家上市,用以识别符合KEYTRUDA免疫疗法条件的未经治疗和有治疗史的转移性非小细胞肺癌(mNSCLC)患者
2017-05-17从临床研究进展深度剖析“阿帕替尼”的真实一面2017-05-17
全球首款庞贝病治疗药物美而赞在中国大陆上市2017-05-15
第三代肺癌靶向药助患者突破耐药瓶颈
泰瑞沙精准接力,全程靶向治疗让患者获得高质量生存。
2017-05-15斯丹赛与Vericel战略合作引进3款FDA获批细胞治疗产品 数千万患者有望受益2017-05-11
SGLT2抑制剂安达唐上市中国 降糖还有心血管获益
作为我国首个钠-葡萄糖共转运蛋白2(SGLT2)抑制剂,达格列净借助全新的、非胰岛素依赖作用机制,通过高选择性地抑制钠-葡萄糖共转运蛋白2(SGLT2),减少肾脏葡萄糖重吸收,通过尿中直接排出多余糖分,从而降低2型糖尿病患者体内的血糖浓度以治疗糖尿病。同时,在达格列净的临床研究中还发现了体重下降和血压下降等结果。
2017-05-08拜万戈(瑞戈非尼)在华上市 创新结直肠癌靶向治疗选择2017-05-08
可用于婴幼儿的13价肺炎球菌多糖结合疫苗上市 多地迎来第一针
3月23日,家长们期待已久的13价肺炎球菌多糖结合疫苗今天起在昆明市、西安市、沈阳市与福州市等多地开始接种。
2017-03-23奥拉帕尼III期研究证实作为BRCA突变卵巢癌的维持治疗可延长疾病无进展生存时间
研究者评估的疾病无进展生存期为19.1个月,而安慰剂组仅为5.5个月,接受奥拉帕尼治疗将疾病进展风险降低70%。奥拉帕尼片剂彰显了与先前研究一致的安全性,包括血液毒性的低发生率。
2017-03-22Motif Bio新型抗生素Iclaprim3期临床试验获得里程碑式进展
REVIVE-1是一项全球多中心进行的双盲临床试验,共招募600例病人,旨在比较Iclaprim(80 mg,静脉注射)与万古霉素(15 mg/kg,静脉注射)的安全性及有效性。治疗频率为每12小时一次,持续时间为5-14天,数据分析结果预计将在2017年第二季度公布。
2017-02-08依维莫司通过英国重新审查 作为二线药物治疗肾细胞癌
诺华重新提交的临床试验数据表明进行VEGF靶向治疗后的病人在服用依维莫司后无进展生存期延长近3个月,总生存时间也比对照组长至少3个月。
2017-01-18FDA将加速审批Keytruda联合化疗治疗肺癌的申请
默克正在等待这个用于治疗所有NSCLC病人联合疗法的批准,换句话讲,一旦这个联合疗法被批准,不管NSCLC病人是否表达PD-L1或者是否存在ALK、EGFR突变,都可以用它进行治疗。该公司认为如果该疗法被批准,将进一步巩固Keytruda在NSCLC治疗领域的核心地位。
2017-01-17默克与Vertex合作开发肿瘤疗法
Vertex公司首先提供给默克公司的是一种Rad3-related (ATR)蛋白激酶抑制剂药物VX-970,这种药物目前处于临床II期研究阶段。
2017-01-17抗疟疾神药氯喹或能有效治疗癌症
氯喹能够通过依赖p53激活的经典分泌通路来诱导Par-4分泌,p53能够直接诱导Rab8b激活,Rab8b是一种GTP酶,其对于Par-4运输到质膜非常重要,本文研究结果表明,氯喹能够诱导正常细胞分泌p53和Rab8b依赖性的Par-4,从而就能够对转移性肿瘤生长进行Par-4依赖性的抑制。
2017-01-13Lucentis获FDA批准治疗近视性脉络膜新生血管
Lucentis旨在结合并抑制血管内皮生长因子A(VEGF-A),该蛋白被认为在新血管的形成(angiogenesis,血管生成)和血管高通透性(leakiness,渗漏)中发挥了关键作用。
2017-01-10诺华Cosentyx获英国NICE批准治疗银屑病关节炎
Cosentyx是一种全人源化单克隆抗体,选择性靶向阻断循环性IL-17A的活性,降低免疫系统的活动并改善疾病症状。研究揭示,IL-17A在驱动机体在斑块型银屑病、强直性脊柱炎(AS)、银屑病关节炎(PsA)的免疫应答中发挥着重要作用。
2017-01-10新型药物或能有效阻断90%的黑色素瘤转移
如今小分子药物占到了90%以上的药物市场,研究者认为,本文研究仅仅是早期发现,他们开发的这种新型小分子药物能够有效抵御致死性的皮肤癌,据估计这种皮肤癌没年大约会引发1万人死亡。appleton说道,黑色素瘤是一种致死性的皮肤癌,在美国每年大约有7.6万新增患者,该病具有如此致死性是因为其能够在全身迅速扩散并且攻击机体中较远距离的器官,比如大脑和肺部等。
2017-01-10武田携手PvP开发乳糜泻治疗药物KumaMax
根据协议条款,PvP将开展全部的研究和开发工作直至完成I期概念验证研究。武田将提供3500万美元的资金资助PvP推进相关工作,作为交换,在临床研究达到相关预定义目标后,武田将拥有收购PvP的独家选择权。武田可以在支付一笔非公开的费用以及开发和监管里程碑金后,行使选择权将PvP收购。
2017-01-10Halozyme胰腺癌疗法临床研究收获积极研究成果
在此次针对难治性胰腺癌临床II期研究中,治疗组患者的无进展生存期均有显着性提高,此外在透明质酸高表达患者群体中也观察到了这一现象。透明质酸一直被认为可能成为胰腺癌的新生不标记物分子。此外,在特定亚群的患者中,PEGPH20可以降低其血栓栓塞发生率。
2017-01-10全球首个脊髓性肌萎缩症治疗药Spinraza获FDA批准
值得一提的是,FDA自收到Spinraza监管文件之后的3个月内便加速批准Spinraza,突显了该领域迫切的严重未满足的巨大医疗需求。在美国和欧盟,Spinraza均被授予孤儿药地位;在美国,Spinraza还获得了快车道地位和优先审查资格;在欧盟也收获了加速审批资格。
2016-12-27强生向FDA提交重磅抗炎药Stelara补充生物制品许可
Stelara是一种单克隆抗体药物,靶向白细胞介素12(IL-12)和白细胞介素23(IL-23),这2种细胞因子被认为在多种免疫介导性疾病中发挥着重要作用。在美国,Stelara已于2009年9月获批用于中度至重度斑块型银屑病成人患者的治疗。
2016-12-27Vimpat获欧盟批准单药治疗部分发作性癫痫
在欧盟,Vimpat于2008年9月首次获批上市,作为一种辅助药物,用于青少年(16-18岁)和成人癫痫患者部分发作性癫痫(伴随或不伴随继发性全面性发作癫痫)的治疗。在欧盟国家中,Vimpat的剂型有薄膜衣片、糖浆、注射液。在暂时无法口服给药的患者中,Vimpat注射液是另一种可选择的剂型。
2016-12-26CHMP认可恩格列净可降低心血管疾病死亡风险
此积极建议是基于EMPA-REG OUTCOME®试验的结果。该试验显示标准治疗基础上加用恩格列净,较安慰剂可显著降低合并心血管疾病的2型糖尿病成人患者的心血管疾病死亡、非致死性心脏病发作或非致死性卒中风险14%。在标准治疗的基础上加用恩格列净可降低心血管疾病死亡风险38%。在非致死性心衰及非致死性卒中风险方面,试验结果无统计学差异。
2016-12-26吉利德乙肝新药Vemlidy(TAF)进入亚洲市场
Vemlidy(TAF,替诺福韦艾拉酚胺富马酸)是一种新型核苷类逆转录酶抑制剂(NRTI),该药是已上市药物Viread(替诺福韦酯,TDF,在日本由葛兰素史克销售)的升级版。在临床试验中,TAF已被证明在低于Viread十分之一剂量时,就具有非常高的抗病毒疗效,同时具有更好的安全性,可改善肾功能和骨骼安全参数。
2016-12-20礼来口服抗炎药baricitinib获欧盟CHMP支持批准
CHMP支持批准的积极意见,是基于一项III期临床项目的积极数据,该项目包括5个III期临床研究(RA-BEGIN, RA-BEAM, RA-BUILD, RA-BEACON, RA-BEYOND),调查了baricitinib在广泛的中度至重度活动性类风湿性关节炎(RA)成人患者群体中的疗效和安全性,其中包括对甲氨蝶呤治疗缓解不足的患者,对常规合成疾病修饰抗风湿药物(csDMARDs)治疗缓解不足的患者,以及对生物类疾病修饰抗风湿药物(bDMARDs,包括TNF抑制剂)治疗缓解不足的患者。
2016-12-19罗氏Alecensa获CHMP支持批准治疗ALK阳性非小细胞肺癌
J-ALEX是首个将Alecensa与Xalkori进行直接对比的ALK阳性肺癌研究。业界认为,该研究的成功对罗氏而言意义重大,Alecensa将直接挑战辉瑞Xalkori在ALK阳性肺癌领域的霸主地位。罗氏之前表示,将根据该研究及其他研究的数据,向全球监管机构提交申请,将Alcensa由加速批准转为完全批准,同时将Alcensa用于ALK+NSCLC的一线治疗。
2016-12-19新型癌症靶向化疗技术或有望引入人类临床试验中
传统的化疗药物能够有效杀灭癌细胞,但一般而言这些药物并不具有选择性,这也就是为何癌症患者往往会经历可怕的药物副作用;相比较而言,新型的癌基因靶向药物具有很好的选择性,但其通常仅仅会有效抵御非常特殊的癌症,然而肿瘤会频繁进化最终对药物产生耐受性,文章中研究者提出的新方法就结合了上述方法的优点,即整合了化疗致命的摧毁力量,同时又能够选择性靶向作用目标癌细胞。
2016-12-15吉利德向FDA提交SOF/VEL/VOX上市申请
SOF/VEL/VOX(400mg/100mg/100mg)是一种日服一次的三合一片剂,开发用于全部6种基因型(GT-1,-2,-3,-4,-5,-6)丙肝患者的治疗。该药由吉利德已上市的泛基因型丙肝鸡尾酒Epclusa中的2种成分(sofosbuvir/velpatasvir)和voxilaprevir组成。其中,sofosbuvir是一种核苷类似物聚合酶抑制剂,velpatasvir是一种泛基因型NS5A抑制剂,voxilaprevir则是一种泛基因型NS3蛋白酶抑制剂。
2016-12-15GSK向欧盟提交慢阻肺三联疗法FF/UMEC/VI上市申请
三联疗法FF/UMEC/VI是一种ICS/LAMA/LABA组合疗法,通过葛兰素史克的Ellipta干粉吸入器给药,每日给药一次。FF/UMEC/VI涵盖了COPD临床治疗中使用最广的3类吸入性药物,其组成为FF(Fluticasone furoate,糠酸氟替卡松,一种吸入性皮质类固醇,ICS)和UMEC(umeclidinium,一种长效毒蕈碱拮抗剂,LAMA)以及VI(vilanterol,维兰特罗,一种长效β2受体激动剂,LABA)。
2016-12-13GSK向EMA提交带状疱疹疫苗Shingrix生物制品上市许可申请
带状疱疹是由水痘带状疱疹病毒(varicella zoster virus ,VZV)引发的疼痛性感染,主要症状为腰背部或身体其它部位发生瘙痒和疼痛。尽管人体的免疫系统通常情况下都能抗击VZV的感染而不出现症状,然而在身体免疫力低下的时候,就会发生疼痛的皮肤损伤。
2016-12-06斯耐瑞获CFDA临床批件 治疗耐多药肺结核
作为比利时杨森公司的重要科研成果,富马酸贝达喹啉片是一种具有创新作用机制、治疗结核病的药物,有望显著改善耐多药肺结核的治疗效果,将满足众多患者的治疗需求。
2016-12-02研究显示:塞来昔布与布洛芬和萘普生具有相似的心血管风险
对于临床诊断为骨关节炎(OA)或类风湿性关节炎(RA),合并心血管疾病高风险且需要每日服用非甾体抗炎药(NSAID)控制关节炎症状的患者,给处方剂量的塞来昔布、布洛芬和萘普生进行治疗,其心血管风险近似。
2016-12-02Genmab/强生Darzalex三联疗法获FDA批准
Darzalex(daratumumab)是一种人源化抗CD38单克隆抗体,具有广谱杀伤活性,靶向结合多发性骨髓瘤细胞表面高度表达的跨膜胞外酶CD38分子,可通过多种机制诱导肿瘤细胞的快速死亡。今年七月份,这一三联疗法获得了FDA的突破性疗法认定,随后强生在八月份向FDA提交了补充生物制品许可(sBLA)申请,正式向二线用药吹响号角。原本FDA预计在明年二月份做出决定,然而最终提前亮起了绿灯。
2016-11-29百时美Opdivo获欧盟批准治疗经典霍奇金淋巴瘤
此次批准,是Opdivo在过去不到2年时间内治疗4种不同类型肿瘤方面在欧盟斩获的第6个批文,包括3种实体瘤以及此次获批的血液系统恶性肿瘤,Opdivo也由此成为欧洲首个获批治疗血液肿瘤的PD-1免疫疗法。
2016-11-25艾伯维修美乐获CHMP支持批准用于治疗青少年化脓性汗腺炎
艾伯维免疫学临床研发部副总裁John Medich表示,化脓性汗腺炎常见于青少年,并且随着时间的推移愈发严重。因此早发现早治疗对于青少年患者尤为重要,有利于改善治疗效果。CHMP的积极意见对于这部分患者非常有利,因为目前还没有批准用于青少年化脓性汗腺炎的生物药。
2016-11-24突破性药物不突破?FDA突破性药物认证引争议
按照FDA官方给出的突破性药物认证(BTD)的解释:这一认证只会授予某种单独或联合其他药物用来治疗严重甚至危及生命的疾病以及早期临床研究预示这一药物可能在一项或多项临床显著性终点中优于现有疗法的新药物产品。
2016-11-24GSK向FDA提交慢阻肺三联疗法FF/UMEC/VI上市申请
三联疗法FF/UMEC/VI是一种ICS/LAMA/LABA组合疗法,通过葛兰素史克的Ellipta干粉吸入器给药,每日给药一次。FF/UMEC/VI涵盖了COPD临床治疗中使用最广的3类吸入性药物,其组成为FF(Fluticasone furoate,糠酸氟替卡松,一种吸入性皮质类固醇,ICS)和UMEC(umeclidinium,一种长效毒蕈碱拮抗剂,LAMA)以及VI(vilanterol,维兰特罗,一种长效β2受体激动剂,LABA)。
2016-11-24安进新一代肾脏病药物Parsabiv获欧盟批准
Parsabiv是过去10多年来继发性甲旁亢(sHPT)领域的首个治疗进展,该药也是首个在患者每次透析结束后每周三次静脉注射给药的静脉注射型拟钙剂。
2016-11-16特朗普操刀改革FDA 新药审批继续提速
网站还提到要加大医疗保健的研究投入和产出,重点关注生物制药。对美国FDA进行改革,聚焦患者对创新医疗产品的需求。此前,特朗普在葛底斯堡演说中提到要精简FDA的新药批准流程。美国目前有4000种药物正在等待批准, 特别希望能加速这一过程。
2016-11-16武田Adcetris重新定义CD30阳性淋巴瘤一线治疗
Adcetris是一种抗体药物偶联物(ADC),靶向CD30蛋白,该蛋白表达于多种类型的非霍奇金淋巴瘤(nHL)及霍奇金淋巴瘤(HL)。目前,Adcetris尚未获批用于MTCL的一线治疗。
2016-11-10BioInvent多发性骨髓瘤免疫疗法药Ⅱ期临床试验被暂停
该项临床试验是由BioInvent公司和美国宾夕法尼亚大学的研究人员共同申办,旨在验证BI-505在临床试验中具有增强治疗反应的能力,可以对那些进行自体造血干细胞移植并服用大剂量美法仑的患者起到预防和延缓多发性骨髓瘤复发的作用。
2016-11-10雅培生命旗下veliparib获美国FDA孤儿药资格认定
PARP是体内一种修复细胞DNA损伤的内源性酶。除正常细胞外,PARP还可以修复肿瘤细胞的DNA损伤,帮助肿瘤细胞在体内存活。研发人员正在研究将Veliparib与DNA损伤疗法联用后是否可以阻碍Veliparib损伤修复机制进而促进肿瘤细胞死亡。
2016-11-10拜耳提交靶向抗癌药Stivarga上市申请
近年来,肝癌的发病率在全球范围内持续升高,目前仅有一种获批治疗肝癌的系统疗法(即拜耳的多吉美Nexavar),还没有被临床证明或获批治疗晚期肝细胞癌(HCC)的二线治疗方案。Stivarga在III期临床研究RESORCE中治疗肝细胞癌所表现出的强大疗效,将为医生、医疗保健提供者及患者提供第二个被临床证明的治疗方案。
2016-11-08安进Enbrel获美国FDA批准治疗儿科斑块型银屑病
Enrel的获批,是基于一项为期一年的III期研究及其5年开放标签扩展研究,这些研究评估了Enbrel治疗慢性中度至重度斑块型银屑病儿科患者的疗效和安全性。数据证明了Enbrel具有非常显著的疗效,安全性方面则与Enbrel在慢性中度至重度斑块型银屑病成人群体中的安全性保持一致。
2016-11-07安斯泰来12.8亿收购Ganymed扩充管线资产
一直以来,安斯泰来都在努力打造自己的肿瘤学管线资产,其中一款重要的产品是前列腺癌治疗药物Xtandi(enzalutamide),与辉瑞合作开发。去年,安斯泰来与Potenza Therapeutics公司签署了一项广泛的免疫肿瘤学协议,之后该公司又与Immunomic Therapeutics达成了一笔3亿美元的授权协议。
2016-11-03癌症治疗方法蕴含阿尔茨海默病治疗新希望
研究人员对阿尔茨海默病小鼠模型进行了三周的纳米脂质体治疗,接受药物治疗的小鼠恢复了长期记忆并且能够在一个24小时周期后重新辨认出类似的物体。相比之下,接受安慰剂注射的小鼠无法记得前一天看到的物体。
2016-10-24舒尼替尼可延长癌症患者术后的无病生存期
在经过一年治疗后,经索坦治疗的受试者至术后复发的中位时间为6.8年,而安慰剂组为5.6年,总体风险减低了24%。在进行分析时,总生存期(OS)数据尚未成熟。
2016-10-21Opdivo治疗转移性尿路上皮癌(mUC)再获新数据
今年5月,美国食品和药物管理局(FDA)批准罗氏肿瘤免疫疗法Tecentriq(atezolizumab)治疗尿路上皮癌(UC),成为获批治疗这类癌症的首个PD-1/PD-L1免疫疗法。今年6月底,FDA授予百时美Opdivo治疗mUC的突破性药物资格,今年9月,欧洲药品管理局(EMA)正式受理Opdivo治疗mUC的申请文件。今年2月,阿斯利康的durvalumab在美国监管方面也获得了治疗mUC的突破性药物资格。
2016-10-14吉利德HIV药物Truvada获英国NICE支持用于PrEP
该报告也强调了在规划PrEP服务时需要考虑的一些重要问题,例如服药及依从性、性行为、耐药性、安全性、预防优先及成本效益。NICE表示,PrEP的成本效益很可能取决于以上这些变量。目前,Truvada的标价是355.73英镑/30片,但该药以一个保密的折扣提供给NHS用于HIV预防。
2016-09-30诺华Cosentyx获英国NICE批准治疗强直性脊柱炎
Cosentyx是全球首个白细胞介素17(IL-17)单克隆抗体,分别于2015年1和2016年1月获欧盟和美国批准强直性脊柱炎(AS)适应症。此次批准,使Cosentyx成为继抗TNF单抗药物上市后16年来强直性脊柱炎(AS)临床治疗方面取得的首个新的治疗突破。
2016-09-30FDA授予罗氏Actemra/RoActemra第2个突破性药物资格
BTD是FDA在2012年创建的一个新药评审通道,旨在加快开发及审查治疗严重的或威胁生命的疾病的新药。获得BTD认证的新药,在研发时能得到FDA高层官员在内的更加密切的指导,保障在最短时间内批准上市,为患者提供新的治疗选择。
2016-09-29新型长效宫内节育器Kyleena获美欧2大市场批准
Kyleena的获批,是基于一项III期临床研究的数据,该研究涉及来自北美、拉美和数个欧洲国家的574例未产妇(nulliparous)和878例经产妇(parous),主要终点为采用珀尔指数(Pearl Index,PI)评价的避孕效果。数据显示,Kyleena的5年珀尔指数为0.29,其在每一年的避孕成功率超过99%。研究中,Kyleena总体耐受性良好,未发生意外的不良事件报告。
2016-09-28Eylea获NICE批准一线治疗视网膜分枝静脉阻塞(BRVO)继发黄斑水肿
目前,在英国,初诊为视网膜分支静脉阻塞(BRVO)继发黄斑水肿(ME)的患者采用的一线治疗方案为激光凝固(laser photocoagulation)。NICE表示,激光凝固相比,Eylea更具有成本效益。此外,NICE还认为,与开展激光光凝之后给予Eylea治疗相比,在激光光凝之前给予Eylea治疗的临床疗效更好。这也使得患者能够在治疗的最早期阶段及时获取Eylea治疗。
2016-09-27FDA一次性批准诺华抗炎药Ilaris 3个新的适应症
Ilaris是一种选择性、高亲和性、全人源化单克隆抗体,靶向抑制白细胞介素-1β(IL-1β),这是人体免疫系统防御的一个重要组成部分。IL-1β的过度产生在某些炎症性疾病中发挥着关键作用。Ilaris通过阻断IL-1β的作用并持续一段时间,从而抑制因过量产生造成的炎症。
2016-09-27NICE拒绝罗氏Esbriet用于早期肺特发性纤维化
2013年,英国NICE曾经基于积极的II期和III期临床试验结果,推荐Esbriet用于中至重度IPF患者。一项纳入更多早期IPF患者、名为ASCEND的III期临床试验显示,经过一年的Esbriet治疗后,IPF造成的死亡风险几乎下降了一半。52周治疗后,Esbriet组的死亡率相较于安慰剂组降低了48%。此外,Esbrie组的用力肺活量(FVC)平均基线下降水平为235 ml,而安慰剂组为428 ml。
2016-09-26欧盟批准首个腹泻型肠易激综合征治疗药物Truberzi
Truberzi的获批,是基于2项关键性III期临床研究的积极数据。数据显示,Truberzi显著降低了腹泻型肠易激综合征2种最令人麻烦的症状,即腹部疼痛与腹泻,持续缓解时间达6个月以上。安全性方面,Truberzi的耐受性良好,治疗最常见的副作用包括恶心、便秘和腹部疼痛。
2016-09-26罗氏新药Ocrevus显著提高多发性硬化症疾病控制
Ocrevus提高了RMS患者和PPMS患者的疾病控制。这些分析中,采用临床预后和MRI检查结果的组合测量来评估疾病控制的2个复合终点:RMS患者是否实现无疾病活动证据(NEDA);PPMS患者是否实现无疾病进展证据(NEP)。这些复合终点正逐渐成为新的临床治疗目标。
2016-09-19安进新一代肾脏病药物Parsabiv获欧盟CHMP支持批准
etelcalcetide是一种新颖的拟钙剂(calcimimetic agent),能够抑制甲状旁腺激素(PTH)的分泌,目前正开发用于接受血液透析治疗的慢性肾脏病(CKD)患者继发性甲旁亢(sHPT)的治疗,在患者每次透析结束后每周三次静脉注射给药。
2016-09-18Shire原发性免疫缺陷症新药Cuvitru获美国FDA批准
随着Cuvitru的获批,Shire公司现在拥有了最广泛的静脉注射和皮下注射免疫球蛋白(IG)产品组合,其中包括唯一的每月一次的皮下注射产品。Shire预计将在未来几周内将Cuvitru推向美国市场。
2016-09-18欧盟批准Exelixis公司口服抗癌药Cabometyx
在欧盟,Cabometyx通过加速审批程序获批,该药是首个在III期临床中在全部3个关键疗效参数方面(总生存期,OS;无进展生存期,PFS;客观缓解率,ORR)均实现强劲的临床意义改善的创新药物。Cabometyx的上市,将为欧洲的晚期肾细胞癌群体提供一种新的二线治疗选择。
2016-09-18Oncolys BioPharma将开展黑色素瘤溶瘤疗法OBP-301临床试验
Oncolys BioPharma是一家位于日本东京的生物技术公司,即将在晚期的、不可切除性的黑色素瘤患者中展开Telomelysin (OBP-301)的II期临床试验。
2016-09-14罗氏牵手BioLineRx开发免疫肿瘤学组合疗法
免疫检查点抑制剂是治疗癌症的一类新的有前途的方法,已变革了多种肿瘤的临床治疗。然而,目前越来越清晰的是,某些类型的肿瘤需要检查点抑制剂与其他类别的药物进行联合治疗,才能表现出较好的疗效。
2016-09-14Opdivo收获日本市场肾癌适应症
2014年,小野制药在专利断崖和仿制药竞争的困局中苦苦挣扎,就在此时Opdivo获批上市,使小野立即摆脱了困境。近日,日本批准Opdivo用于治疗转移性、不可切除性的肾细胞癌,虽然不如黑色素瘤和非小细胞肺癌那样市场巨大,但仍是一个不小的市场。肾细胞癌是肾癌中最为常见的一种,世界范围内每年导致11万人死亡,五年生存率仅为12%。
2016-09-12AZ哮喘药物benralizumab两项III期临床取得成功
Benralizumab是一种单克隆抗体,能够与白细胞介素5受体的α亚基(IL-5Rα)结合,消耗嗜酸性粒细胞。嗜酸性粒细胞是一种白细胞,在引发哮喘、哮喘严重程度及哮喘发作中发挥了关键作用。越来越多的证据表明,对于嗜酸性粒细胞计数升高的哮喘患者,除基于指南的治疗策略外,利用一种IL-5抑制剂可能改善患者的哮喘控制并降低哮喘发作的频率。2013年10月,阿斯利康宣布启动benralizumab的III期临床项目。
2016-09-09欧盟扩大诺和诺德糖尿病鸡尾酒疗法Xultophy适应症
Xultophy由Tresiba(insulin degludec,德谷胰岛素)和Victoza(liraglutide,利拉鲁肽)组成。其中,Tresiba是一种长效基础胰岛素;Victoza则属于胰高血糖素样肽1(GLP-1)受体激动剂,能够刺激天然胰岛素分泌,该药是诺和诺德的重磅产品,年销售额高达20亿美元,在GLP-1市场傲视群雄。
2016-09-09武田启动登革热疫苗TAK-003全球性III期临床研究
TAK-003全球性III期TIDES研究的启动,是基于之前在多个年龄组中开展的I期和II期临床研究,这些研究评估了疫苗的耐受性、安全性以及针对全部4种血清型登革热病毒的免疫原性。
2016-09-08Retrophin罕见肾病药sparsentanII期临床效果显著
有意思的是,公司充满争议的前任CEO Martin Shkreli立刻在社交媒体发声,表示sparsentan是他在公司首个参与研发的药物。Shkreli在2014年被Retrophin公司辞退,公司起诉他将公有资产用于个人原因,以维持他个人的投资公司。
2016-09-08FDA授予TG Therapeutics公司2个药物孤儿药地位
视神经脊髓炎(NMO)与多发性硬化症密切相关,在美国讯在着巨大的医疗需求。TG Therapeutics公司已计划在今年9月份居心的欧洲多发性硬化症治疗及研究委员会(ECTRIMS)会议上公布目前正在推进的TG-1101治疗NMO的一项1b期临床研究数据。此外,该公司已计划在2017上半年推进TG-1101进入治疗多发性硬化症的关键临床研究,这是更大的一个治疗市场。
2016-09-02诺华Enbrel生物类似药Erelzi获美国FDA批准
Erelzi是FDA批准的首个依那西普生物类似药,也是诺华山德士在美国市场继Zarxio(安进Neupogen[gilgrastim,非格司亭]的生物类似药)之后获批的第二款生物类似药,同时也是FDA批准的美国市场的第三款生物类似药。
2016-09-02欧盟批准辉瑞Xalkori治疗ROS1阳性非小细胞肺癌
此次批准,是基于一项多中心单组I期研究(Study 1001)的积极数据。该研究在53例证实为ROS1重排的转移性非小细胞肺癌(NSCLC)患者中开展,调查了Xalkori的治疗潜力。研究中对患者采用标准方案的口服剂量Xalkori(250mg,2次/天)治疗,评估药物的安全性、药代动力学和治疗应答,同时利用第二代测序技术及RT-PCR确定ROS1融合伴侣基因。
2016-09-02百健阿尔兹海默症新药获FDA快速审批待遇
Biogen CEO George Scangos在声明中表示,随着科学家对阿尔兹海默症疾病机理了解的深入以及生物标记物在该疾病研究中的广泛应用,关于该疾病新药开发的成功率也随之大大增加。
2016-09-02FDA加速批准Blincyto治疗儿科Ph-急性淋巴细胞白血病
Blincyto是全球首个双特异性T细胞免疫疗法。之前,Blincyto已分别于2014年底和2015年底获美国FDA和欧盟EMA加速批准,用于费城染色体阴性(Ph-)复发性或难治性前体B细胞急性淋巴细胞白血病(ALL)成人患者的治疗,这是儿童和成人群体中一种罕见、进展迅速的血液癌症。
2016-09-02Arzerra获FDA批准治疗复发性慢性淋巴细胞白血病
此次批准,是基于III期COMPLEMENT-2临床研究的数据。该研究在复发性慢性淋巴细胞白血病(CLL)患者中开展,数据显示,与氟达拉滨+环磷酰胺治(FC)疗组相比,Arzerra联合氟达拉滨及环磷酰胺(AFC)使中位无进展生存期(PFS:28.9个月 vs 18.8个月,p=0.0032)得到了统计学意义的显著延长,延长幅度达54%,达到了研究的主要终点。
2016-09-02FDA受理杰特贝林皮下预防性治疗药物CSL830上市申请
遗传性血管性水肿(HAE)即补体 C1抑制因子(C1 inhibitor,C1-INH)缺乏症,是一种罕见的遗传性疾病,该病的发病率为1:10000-1:50000。HAE患者C1-INH基因存在缺陷,导致体内C1-INH蛋白缺失或功能障碍,该蛋白参与机体免疫系统对炎症的控制。
2016-09-01维生素C或可增加AML标准疗法的疗效
体而言,来自美国南加州大学、温安德尔研究所(Van Andel Research Institute)和丹麦哥本哈根大学国王医院(Rigshospitalet)等机构的研究人员在实验室研究中证实在癌细胞系中,往一种被称作地西他滨(decitabine)的表观遗传抗癌药物中添加一种维生素C会增加这种药物阻止癌细胞生长和触发癌细胞自我摧毁的能力。
2016-09-01拜耳眼科药物Eylea获NICE批准作为一线治疗方案
视网膜分支静脉阻塞(BRVO)的发病原因为:视网膜主血管分支上出现血栓,导致小血管内压升高,进而导致黄斑下血液或液体渗出(黄斑水肿)。如果不能及时有效治疗,视网膜分支静脉阻塞(BRVO)导致的黄斑水肿会极大地影响患者的视力。
2016-08-30FDA暂缓批准赛诺菲/Zealand糖尿病新药IGlarLixi
IGlarLixi是一种胰岛素-GLP-1组合疗法。目前美国市场上尚没有同类产品上市。这一结果对于赛诺菲的老对手诺和诺德无疑是个众大利好消息。因为这意味着后者开发的同类产品IDegLira将在这场竞争中占据上风。
2016-08-30抑制肺癌患者对药物产生耐受性的新策略
HAPs可以通过在肿瘤的低氧斑块下杀灭癌细胞来发挥作用,而标准的药物很难渗入到肿瘤的低氧斑块中;然而在临床试验中HAPs对患者并没有表现出明显的效益,本文研究中来自明尼苏达大学和南加利福尼亚大学的研究者就开始进行研究调查如何使HAPs变得更加有效。
2016-08-29新一代高效乳腺癌药物或即将诞生
乳腺癌作为一种常见的女性癌症,每年在全世界其能够引发50多万名女性死亡,而当前的乳腺癌疗法并没有特殊靶向作用该蛋白。研究者Daniel Ryan说道,这项研究可以帮助我们解释当前的乳腺癌药物如何在机体细胞中发挥作用,如今用于治疗乳腺癌的药物非常有效,但我们并不清楚这些疗法的作用机制,这项研究中我们就发现了一组重要的蛋白质,其可以被这些药物靶向作用,或许未来就可以开发出效果更好的靶向疗法。
2016-08-29艾伯维venetoclax进入英国早期获药计划(EAMS)
今年四月份,该药物在美国获批上市。此次获批主要是基于一项单臂临床试验的积极数据,该临床试验纳入了106名既往接受过治疗的、且17p染色体缺失的CLL患者,其中80%的患者取得了完全或部分缓解。
2016-08-26安进新一代肾脏病药物Parsabiv上市申请遭FDA否决
Parsabiv新药申请(NDA)的提交,是基于3个III期临床研究的数据,其中2个为安慰剂对照研究,另一个是头对头研究,这3个研究均达到了主要终点。去年2月公布头对头III期数据显示,Parsabiv疗效轻松击败安进自身已上市产品Sensipar(cinacalcet,西那卡塞),该药是FDA批准用于接受透析治疗的慢性肾病成人患者治疗SHPT的首个口服拟钙剂,在2015年销售额实现突破10亿美元。业界对Parsabiv的商业前景十分看好,认为该药将成为安进的又一款重磅产品。
2016-08-26FDA授予口服BACE抑制剂AZD3293快车道地位
BACE抑制剂是一个新的药物类别,根据已取得的临床数据来看,该类药物有望为阿尔茨海默氏症的临床护理带来一场革命。目前,美国制药巨头默沙东是BACE抑制剂研发领域的全球领导者,该公司眼下正在大型安慰剂对照II/III期临床中对其BACE抑制剂MK-8931进行评价,首批III期临床数据预计将于2017年左右获得。
2016-08-24Xalkori获英国NICE推荐 一线治疗ALK阳性肺癌
Xalkori在英国可用作一线治疗药物,用于ALK阳性晚期非小细胞肺癌(NSCLC)患者,成为该群体中可取代静脉输注化疗药物的首个口服治疗选择。据估计,在英格兰和威尔士,大概有459例患者有资格接受Xalkori一线治疗。此外,Xalkori也被苏格兰医药协会(SMC)推荐用于ALK阳性晚期非小细胞肺癌。
2016-08-24梯瓦每月一次哮喘药新药Cinqaero获欧盟批准
Cinqaero每4周静脉注射一次,该药的获批,是基于临床开发项目BREATH的数据。来自2项关键性、安慰剂对照III期临床研究的数据显示,与安慰剂组相比,Cinqair治疗组哮喘发作频率显著降低且哮喘发作间隔延长,同时患者的肺功能也得到显著提高。
2016-08-24默沙东丙肝药物Zepatier获欧盟委员会批准
Zepatier是一种每日口服一次的固定剂量组合片剂,由一种HCV NS5A抑制剂elbasvir(50mg)和一种HCV NS3/4A蛋白酶抑制剂grazoprevir(100mg)组成。
2016-08-09施贵宝Opdivo折戟NSCLC一线疗法!
此次施贵宝公司使用Opdivo单药治疗与研究者选择的化疗方案在晚期NSCLC患者中的疗效差异。Opdivo组患者每2周接受一次Opdivo 治疗,对照组患者接受化疗。患者经检测为PD-L1表达阳性且之前未接受过化疗治疗。
2016-08-08鼻子里发现的新型抗生素可有效杀伤“超级细菌”
研究者们通过对90名参与者的鼻腔细菌样本进行了系统的分析,发现了一类叫做“路邓葡萄球菌”细菌。之后,他们从这类细菌中提纯了一种叫做“路邓素”的物质,这是一类完全新型的抗生素。
2016-08-04Zavicefta达医院获得性肺炎III期临床主要终点
上个月,Zavicefta获得欧盟委员会批准,用于静脉输注治疗复杂性腹腔内感染(cIAI)、复杂性尿路感染(cUTI,包括肾盂肾炎)、医院获得性肺炎(HAP,包括呼吸机相关肺炎VAP)成人患者,以及由好氧革兰氏阴性菌所致感染但缺乏治疗选择的成人患者。
2016-07-28PTC杜氏肌营养不良药物Translarna获NICE支持批准
杜氏肌营养不良症在研的候选药物很多,但由于研发上的种种挫折,目前只有Translarna一种药物获得欧盟有条件批准,并且就在今年2月份,该药物还被美国FDA拒绝批准。据悉,NICE批准后,5年内英国将有50至60名儿童通过医保接受Translarna治疗。
2016-07-28辉瑞/Spark血友病基因疗法获FDA授予突破性疗法认定
SPK-9001是一种基因疗法,本质上是经过基因工程改造的腺病毒,其衣壳表达经密码子优化的、高活性的人凝血因子IX。SPK-9001目前已经进行了I/II期临床试验,今年5月份,辉瑞及Spark Therapeutics宣布该临床试验得到了很好的数据,在I/II期临床研究中,受试者接受一次静脉输注SPK-9001。
2016-07-26阿斯利康DPP4/SGLT2抑制剂组合疗法Qtern获欧盟批准
Qtern的活性成分是阿斯利康的DPP-4抑制剂Onglyza (saxagliptin)和SGLT2抑制剂Farxiga/Forixiga (saxagliptin),值得一提的是,这是继礼来/勃林格殷格翰Glyxambi(linagliptin/empagliflozin)之后第二个获批的DPP-4抑制剂+SGLT2抑制剂组合疗法。Glyxambi去年被FDA批准,但还没有在欧洲获批,这意味着Qtern将是欧洲首个上市的DPP-4/SGLT2抑制剂组合疗法。
2016-07-26Valeant牛皮癣新药艰难通过FDA专家委员会审查
Brodalumab是一种靶向IL-17受体的单克隆抗体药物。此前该药物由安进公司和阿斯利康公司合作研发。然而去年五月份由于临床研究中发现该药物可能会导致患者出现自杀倾向后,安进公司决定从中抽身。当年八月份,Valeant公司加入该项目。如今,Valeant公司持有该药物在全球大部分市场的销售权。
2016-07-22TNF抑制剂Cimzia获英国NICE批准用于类风湿性关节炎
NICE发布的指南称,Cimzia不仅可以作为单药疗法,还可以与甲氨蝶呤联用,治疗对其它药物无应答或者不耐受的类风湿性关节炎。将Cimzia纳入医保后,将对优时比扩大Cimzia在英国的市场非常有利。
2016-07-21肺癌患者福音!苏格兰医药协会批准两款NSCLC新药
英国药物成本控制与监管机构NICE对于价格昂贵的重磅新药一直持否定态度,百时美的PD-1抑制剂Opdivo (nivolumab)已经收到NICE在肾癌和非小细胞肺癌方面的两封拒信,百时美对此表示非常遗憾。
2016-07-19FDA扩大批准肺炎球菌疫苗Prevnar 13用于49岁以下成人
Prevnar 13是辉瑞疫苗产业管线的重要产品,最初是由惠氏公司研发的。2009年,惠氏在其畅销疫苗Prevnar的基础上研发了Prevnar 13,并获得了FDA的优先审批资格。Prevnar13可以预防13种血清型肺炎链球菌,该病菌可导致一系列的疾病,包括耳部感染、肺炎和脑膜炎等。2009年下半年,Prevnar13被制药巨头辉瑞收购,从此成为辉瑞旗下产品。
2016-07-19阿斯利康叫板FDA 要求终止批准瑞舒伐他汀仿制药
Crestor的首个专利保护权已经到期,但是阿斯利康近期获得了新的儿科适应症,在该适应症方面重又获得了七年的保护期,阿斯利康希望将这一专利保护时间拓展至其它所有适应症。阿斯利康已经申请了临时法庭命令,在专利权案做出最终审判前,阻止FDA批准更多的Crestor仿制药。
2016-07-14辉瑞Sutent辅助治疗肾细胞癌III期临床获得成功
值得一提的是,S-TRAC研究是一种酪氨酸激酶抑制剂(TKI)用于RCC辅助治疗方面显著延长DFS的首个临床研究,该研究的数据,将支持Sutent用于更广泛的患者群体。辅助治疗(adjuvant therapy)的概念是帮助降低早期阶段癌症患者的癌症复发风险。
2016-07-14逆势而为?Patheon将进行6亿2千5百万美元IPO
Patheon公司在百健公司前CEO James Mullen的带领下已经给2015财年交上了一份满意的答卷。公司2015年财年销售额达到了18亿美元之多。
2016-07-13日本Ono3亿获得Celyad新型肿瘤免疫疗法地区特许权
Celyad公司2015年收购了OnCyte时获得了NKR-2疗法。公司希望该项目能够为CAR-T疗法开启一扇新的大门。研究人员介绍称,NKR-2 T细胞疗法能够识别多种肿瘤抗原,并使T细胞表达自然杀伤细胞受体NKG2D。当NKG2D与肿瘤表面配体结合时,就能杀死肿瘤细胞。
2016-07-13Shire儿童短肠综合征药物Restive获欧盟委员会批准
短肠综合征是由于不同原因造成小肠吸收面积减少而引起的一个临床症候群,多由广泛小肠切除、小肠短路手术造成保留肠管过少,从而导致患者营养吸收障碍、腹泻等症状,严重时甚至可以危及生命。
2016-07-13Ferring前列腺癌药物Firmagon获英国NICE支持批准
Firmagon (degarelix)是一种促性腺激素释放激素受体阻滞剂,该药已分别在美国和欧美获批用于晚期激素依赖性前列腺癌治疗,在日本被批准用于前列腺癌治疗。
2016-07-13重磅!最新研究再次肯定HIV疫苗RV144的效用
研究者Sekaly表示,本文的研究结果有效消除了我们此前的认知,即RV144疫苗结合MF59佐剂后可以发挥更加有效的结果,相反我们发现修饰后的疫苗实际上可以诱发感染位点先天性细胞的募集反应,当然如今我们已经证实了RV144疫苗在抑制猕猴HIV/SIV感染上的作用,这就为我们近期开发在人类中使用的疫苗提供了一定帮助。
2016-07-12Shire将再次提交小儿多动症药物SHP 465美国上市申请
Shire最早在2006年就向FDA提交了上市申请,但是FDA一直对临床试验结果不够满意,希望Shire提供更多的临床试验数据表明其安全性和有效性,因此该药物的监管一直处于停滞不前的状态。
2016-07-12Juno出大事!CAR-T疗法临床研究患者突然死亡惊动FDA
事实上,在公司的电话会议中,Juno公司CEO Hans Bishop已经将JCAR015预计上市的时间由2017年推迟到2018年。此外,他还提到了今年五月份发生的一例患者死亡事件,该患者同样是死于神经毒性。当时公司与FDA讨论后决定继续进行该项目的临床研究。值得注意的是,死亡的三名患者均为年轻人。
2016-07-11百时美收购Cormorant 加强肿瘤微环境及免疫组合资产
HuMax-IL8是一种靶向白细胞介素8(IL-8)的单克隆抗体,目前正处于I/II期临床开发。IL-8是许多实体瘤表达于肿瘤微环境中的一种蛋白质,能够抑制免疫系统,增强肿瘤转移的能力。通过靶向IL-8,HuMax-IL8具有增强免疫反应的潜力,而通过联合用药,HuMax-IL8还有望提高现有抗癌药物的疗效。
2016-07-11赛诺菲与美国陆军研究所(WRAIR)合作开发寨卡疫苗
WRAIR将共享与免疫检测开发相关的数据,这些免疫检测旨在检测自然感染和ZPIV疫苗接种后的中和性抗体反应、在开展非人类灵长类动物研究中获得的生物样品、以及在使用ZPIV疫苗开展的人体安全性和免疫原性研究中获得的生物样品。
2016-07-11新一代药物坎格列净或可有效治疗2型糖尿病
SGLT2蛋白可以重新吸收从肾脏回流到血液中的葡萄糖,如果抑制了该过程,更多的葡萄糖就会出现在尿液中,而血液中葡萄糖含量就会减少,而这对于糖尿病患者而言是非常有益的。文章中研究者通过研究发现,名为坎格列净的药物可以有效治疗2型糖尿病。
2016-07-11瑞戈非尼显著改善无法切除的肝癌患者的总生存期
拜耳公司日前公布了III期RESORCE研究的结果,和使用安慰剂联合最佳支持治疗的对照组相比,瑞戈非尼联合最佳支持治疗可显著改善患者的总生存期。
2016-07-07强生获得OSE公司CD28拮抗剂药物授权
此次强生公司是通过旗下的杨森制药与OSE公司达成的合作协议。公司将先向OSE公司支付1000万美元的预付款。如果FR104能够达到预期疗效,公司将会接手该药物的全球研发和商业化权利。
2016-07-07百健和艾伯维药物Zinbryta获欧盟批准
T细胞据认为在诸如多发性硬化症(MS)等自身免疫疾病中异常激活。daclizumab被认为通过降低异常激活的T细胞和促炎性淋巴组织诱导细胞、增加CD56bright NK 细胞发挥作用。NK细胞是一类重要的细胞,能够靶向作用于在多发性硬化症(MS)中发挥关键作用的激活免疫细胞,帮助调节免疫系统。
2016-07-07赛诺菲新一代降脂药Praluent获日本批准
有意思的是,在美国市场,安进Repatha原本处于领先地位,但赛诺菲在冲刺阶段史无前例地花了6750万美元买了一张加速审评券,使Praluent审查周期从正常的10个月缩短至6个月实现超越安进,但在其他市场Praluent在监管方面仍落后于Repatha。
2016-07-07安进药物Kyprolis获欧盟委员会批准扩大适应症
去年11月份,Kyprolis获得欧盟委员会批准,联合Revlimid (lenalidomide)以及地塞米松作为复发性多发性骨髓瘤的二线治疗方案,而早在2012年,那时Kyprolis还属于Onyx公司旗下产品,就已经在多发性骨髓瘤中收获了美国监管方面的批文。
2016-07-07诺华药物midostaurin整体缓解率达60%
进展期肥大细胞增多症表现为异常增殖的肥大细胞累积侵犯骨髓、肝脏、脾脏以及其它器官,造成相应的器官损伤、血细胞计数低、体重减轻以及全身瘙痒等系统性症状。 研究表明,系统性肥大细胞增多症的主要分子机制为KIT基因的异常激活,从而导致肥大细胞的异常增殖和存活。
2016-07-07默沙东与Premier达成战略合作预防骨质疏松症患者骨折
Premier是一家领先的医疗保健改善公司,汇集了由美国3600家医院和12万个供应商组成的一个医疗保健联盟。根据协议,此次合作将结合默沙东的专业知识和资产以及Premier公司的医疗系统联盟及性能改进架构和分析能力,同时联合其他医疗保健领导者,联合开发和测试有效的解决方案,帮助改善患者的护理和健康,同时降低医疗保健支出。
2016-07-07触摸屏胰岛素泵mylife YpsoPump 获欧盟批准
mylife YpsoPump是市面上最小和最轻的胰岛素泵(只有83g,包括电池和胰岛素泵筒在内),配置有一块超具现代感的精心设计的小尺寸高对比度触摸屏,具有基于图标和语言的用户界面,菜单导航简洁明了、非常易用。值得一提的是,mylife YpsoPump还荣获过世界工业设计领域的“奥斯卡金像奖”——红点奖(Red Dot Award)。
2016-07-07卫材在墨西哥推出新型口服抗癌药Lenvima
Lenvima是治疗分化型甲状腺癌的首个分子靶向治疗药物,该药作为一种具有重大公共卫生利益的创新药物,将帮助解决难治性分化型甲状腺癌(DTC)群体中存在的严重未获满足的巨大医疗需求。业界预测,Lenvima将成为卫材新的摇钱树,年销售峰值将突破10亿美元。
2016-07-06修美乐获FDA和欧盟批准治疗非感染性葡萄膜炎
Humira是艾伯维的超级重磅产品,连续数年稳坐全球“药王”宝座,该药2015年销售额高达140亿美元,而临床适应症方面也在稳步增加。当前,生物仿制药浪潮已经来袭,但业界认为这对Humira的影响十分有限,有分析师预测,Humira在2020年的销售额仍将高达148亿美元。艾伯维则表示,计划在2020年冲击180亿美元大关。
2016-07-04欧盟批准Simponi治疗多关节型幼年特发性关节炎
pJIA是17岁以下儿童群体中最常见的关节炎类型,主要症状是持续性关节疼痛、肿胀和僵直。据估计,在欧洲有近6万例pJIA患者。Simponi的上市,标志着欧洲活动性pJIA群体临床治疗的一个重大里程碑。
2016-07-04Imbruvica治疗慢性移植物抗宿主病的突破性药物资格
移植物抗宿主病(GVHD)是由于移植物的抗宿主反应而引起的一种免疫性疾病,是异基因造血干细胞移植的主要并发症和造成死亡的主要原因。GVHD患者最常见的受累器官为皮肤、胃肠道和肝脏。目前,尚无获批治疗GVHD的药物。临床上,大多数患者采用糖皮质激素(glucocorticoids)治疗,这是一类类固醇药物,但许多患者对该类药物无响应。
2016-07-01液态阿司匹林杀死脑癌细胞的效率比化疗提高10倍!
脑瘤研究首席执行官Sue Farrington Smith说,“对脑瘤研究而言,这项研究是潜在的游戏规则改变者。诸如此类的科学研究将能够让我们最终发现一种治愈这种严重性疾病的方法,其中相比于任何一种其他的癌症,这种疾病杀死更多的儿童和40岁以下的成年人。”
2016-06-30新疗法仅需单剂注射和一束光就可杀死高达95%的癌细胞
Gdovin的一流研究涉及将一种化合物---硝基苯甲醛(nitrobenzaldehyde)---注射进肿瘤组织中,并允许它在其中扩散。他随后将一束光照向这种肿瘤组织,导致肿瘤细胞在组织内部具有极强的胞内酸性,并因此自杀。在两个小时内,Gdovin估计高达95%的癌细胞死亡。
2016-06-30欧盟批准阿斯利康Zavicefta治疗严重细菌性感染
Zavicefta(ceftazidime-avibactam,CAZ-AVI,头孢他啶-阿维巴坦)是由一种广谱头孢菌素ceftazidime(头孢他啶)和一种新一代非β-内酰胺类β内酰胺酶抑制剂avibactam(阿维巴坦)组成的复方产品,开发用于治疗广泛的革兰氏阴性菌感染,包括多重耐药铜绿假单胞菌、碳青霉烯类抗生素耐药的革兰氏阴性菌,产ESBL肠杆菌科细菌。ceftazidime(头孢他啶)是第三代头孢菌素,这是一种常用于治疗严重革兰氏阴性菌感染的抗生素产品。Zavicefta产品中所添加的avibactam成分,将保护ceftazidime免于被这些耐药阴性菌所产生的β-内酰胺酶的分解。
2016-06-29FDA批准吉利德全球首个泛基因型丙肝鸡尾酒Epclusa
FDA批准的Epclusa治疗方案为:(1)Epclusa单药治疗12周,用于无肝硬化或伴有代偿期肝硬化(Child-Pugh A级)的丙肝患者;(2)Epclusa联合利巴韦林(RBV)治疗12周,用于伴有失代偿期肝硬化(Child-Pugh B或C级)的丙肝患者。
2016-06-29Keytruda治疗晚期非小细胞肺癌新适应症获CHMP支持批准
数据显示,在任意PD-L1表达水平的NSCLC患者中,与多西他赛化疗相比,Keytruda显著延长了总生存期(OS)。KEYNOTE-001是一项多中心、开放标签、多组、疗效预测Ib期研究,评估了Keytruda治疗多种晚期癌症的疗效和安全性。其中肺癌组包括初治和经治晚期非小细胞肺癌(NSCLC),主要疗效终点为总缓解率(ORR)。
2016-06-28Opdivo斩获FDA第6个突破性药物资格
膀胱癌(BC)是全球第9大最常见癌症类型,每年新增43万例,死亡超过16.5万例,男性发病率为女性3倍。大多数膀胱癌在较早的阶段确诊,但疾病复发和恶化率非常高,大约78%的患者在5年内会经历病情复发或恶化。生存率取决于癌症所处的阶段和类型,对于IV阶段膀胱癌,5年存活率仅为15%。
2016-06-28葛兰素史克新型狼疮药Benlysta获英国NICE批准
Benlysta是首个B淋巴细胞刺激因子(B lymphocyte stimulator,BLyS)特异性抑制剂,能阻断可溶性BLyS(一种B细胞生存因子)与B细胞上的BLyS受体的结合。Benlysta与B细胞不直接结合,但通过与BLyS结合,Benlysta可抑制B细胞(包括自身反应性B细胞)的生存、减少B细胞向制造免疫球蛋白的浆细胞的分化。
2016-06-27吉利德新药Odefsey(R/F/TAF)获欧盟批准
生物等效性研究证实,HIV三合一复方新药Odefsey(R/F/TAF)达到了与四合一HIV新药Genvoya(E/C/F/TAF)相同的TAF和恩曲他滨(F)血药浓度,以及与另一款HIV药物Edurant(rilpivirine,R,25mg)相同的利匹韦林(R)血药浓度。
2016-06-27FDA授予Jakavi治疗GVHD的突破性药物资格
今年3月,Incyte和礼来修订ruxolitinib的授权、开发和商业化协议,使Inycte能够独立开发和商业化ruxolitinib用于移植物抗宿主病(GVHD)的治疗。今年4月,Incyte和诺华修订ruxolitinib的合作和授权协议,授予诺华在美国以外国家和地区研究、开发和商业化ruxolitinib治疗移植物抗宿主病(GVHD)的权利。
2016-06-27CFDA批准台湾太景新抗生素产品Taigexyn
之前,Taigexyn 250mg 胶囊已于2014年3月获台湾食品药品管理局(TFDA)批准用于社区获得性细菌性肺炎(CAP)的治疗。此次CFDA批准,也标志着Taigexyn获得的第二个市场批准,将进一步扩大该产品的商业前景。除了口服制剂,太景拟在2016年下半年向CFDA提交静脉注射制剂的上市申请。
2016-06-21NICE批准Boston Scientific激光设备治疗前列腺肥大
GreenLight XPS系统通过特殊设计可以将激光束的能量增强50%以上,同时设备的组织汽化效率也更高。该设备是公司此前以16.5亿美元的价格从Endo公司获得的。此前,这种设备已经获得了FDA的审核批准和CE认证。
2016-06-20Gazyvaro获欧盟批准用于滤泡性淋巴瘤的治疗
Gazyva的成功,对罗氏意义重大,该药将减少生物仿制药对其已上市重磅药物美罗华(Rituxan)的冲击。目前,罗氏也正在其他一些类型癌症中评价Gazyva的疗效。
2016-06-17进击的百时美!新西兰批准Opdivo治疗黑色素瘤
百时美的Opdivo (nivolumab)目前已经在欧美拿下黑色素瘤、肾细胞癌、非小细胞肺癌、经典霍奇金淋巴瘤等适应症,并且仍在多种实体瘤中进行临床试验。未来相信百时美在扩大适应症的同时,还会更加关注亚洲、南美洲、大洋洲等市场。
2016-06-16梯瓦Vantrela ER获FDA专家委员会支持批准
FDA麻醉和镇痛药物咨询委员会以及药物安全和风险管理咨询委员会以14:3的投票结果支持批准梯瓦的不致成瘾性阿片类止痛药Vantrela ER,用于替代疗法无效、需要阿片类止痛药24小时缓解疼痛的慢性患者。梯瓦此次向FDA提交了Vantrela ER(氢可酮酒石酸氢盐)三种不同给药途径的剂型,分别为口服、鼻腔给药、静脉注射,而FDA专家咨询委员会分别给出了14:3、14:3、16:1三种积极的投票结果。
2016-06-16辉瑞止痛药ALO-02获FDA专家委员会支持批准
FDA麻醉和镇痛药物产品咨询委员会和药物安全性和风险管理咨询委员会以9:6的投票结果支持批准ALO-02(盐酸羟考酮/盐酸纳曲酮)缓释胶囊,用于需要24小时维持疼痛缓解的慢性疼痛患者。FDA专家委员会支持的给药途径为鼻内给药(11:4)和静脉注射(9:6),而不支持口服给药(6:9)。
2016-06-15抗梭菌感染单抗Zinplava获FDA专家委员会支持批准
bezlotoxumab是一种实验性抗毒素(antitoxin),与临床上治疗艰难梭菌(C.difficile)感染所采取的标准抗生素护理进行联合用药。bezlotoxumab不是一种抗生素,而是一种单克隆抗体,旨在中和艰难梭菌(C.difficile)的毒素B(toxin B),阻断毒素与细胞结合的能力,这种毒素可损伤肠壁、引发炎症,导致一种致命性的艰难梭菌(C.difficile)相关性腹泻。
2016-06-13欧盟批准安维汀联合特罗凯一线治疗EGFR激活突变型非小细胞肺癌
Avastin和Tarceva分别靶向的信号通路均为肿瘤生长和发展的关键驱动因素,Avastin+Tarceva组合疗法的疗效也得到了其他临床研究的结果支持,这些研究显示,该组合有效且可耐受。
2016-06-13Atezolizumab重新训练免疫系统高效地抵抗晚期膀胱癌
作为这些最新研究发现的一部分,在119名接受实验性试药物atezolizumab注射的患者当中,有28人(占24%)的肿瘤萎缩了30%以上,而且阻止新的肿瘤生长。所有的这些病人接受这种药物注射作为他们对这种疾病的首次治疗。作为一类被称作检查点抑制剂(checkpoint inhibitor)的药物中的一员,atezolizumab(商标名为Tecentriq)是上个月被美国FDA批准销售的。
2016-06-08FDA授予强生埃博拉病毒检测试剂盒紧急使用授权
Idylla EBOV Test是一款诊断试剂盒,用于伴有埃博拉病毒感染迹象和症状的患者,检测埃博拉扎伊尔病毒(Ebola Zaire virus)的存在。该试剂盒由强生旗下杨森诊断和Biocartis NV公司联合开发。
2016-06-07FDA批准诊断显像剂Netspot诊断罕见的神经内分泌肿瘤
NetSpot是一种无菌、静脉内注射使用的单剂量镓68 DOTATATE试剂盒。之前,该产品已获得FDA的优先审评资格和孤儿药地位。Ga 68 dotatate的吸收水平反映了神经内分泌肿瘤(NETs)中生长抑素受体的密度。这种吸收也可以在其他各类肿瘤或其他病例条件下观察到,Ga 68 dotatate的吸收可能需要通过组织病理学或其他评估措施确定。
2016-06-07欧盟将Kite制药公司CAR-T疗法KTE-C19纳入PRIME
KTE-C19是一种实验性疗法,其原理是将患者的T细胞进行基因修饰表达一种旨在靶向抗原CD19的嵌合抗原受体(CAR),CD19是一种表达于多种血液肿瘤细胞表面的抗原蛋白,包括B细胞淋巴瘤和白血病细胞。
2016-06-07欧盟批准依鲁替尼用于治疗慢性淋巴细胞白血病
依鲁替尼主要由杨森制药旗下Cilag GmbH International公司和艾伯维旗下Pharmacyclics LLC公司合作开发,目前已相继被批准用于套细胞淋巴瘤(MCL) 、慢性淋巴细胞白血病(CLL)、17p缺失的慢性淋巴细胞白血病(CLL)及华氏巨球蛋白血症。
2016-06-06干细胞基因疗法Strimvelis获欧盟批准治疗ADA-SCID
Strimvelis(自体CD34+细胞转导表达腺苷脱氨酶(ADA))是首个离体(ex-vivo)干细胞基因疗法,也是全球获批的首个用于儿科患者的纠正性基因疗法,用于无合适人类白细胞抗原(HLA)相匹配干细胞捐献者的ADA-SCID患者的治疗。
2016-06-02Amicus Therapeutics药物Galafold获欧盟批准
Amicus Therapeutics表示,公司已经在筹划为德国市场供货事宜,欧洲的其它国家也在该药物第一批商业推广的范围内。据悉该药物获批的消息一经发布,Amicus的股价大涨7%,符合此前分析师的预计。
2016-06-02罗氏Gazyva达滤泡性淋巴瘤III期临床主要终点
Gazyva又名GA101,是首个糖基化的II型抗CD20单克隆抗体,靶向B细胞表面的CD20分子,能够直接诱导B细胞死亡,而不作用于干细胞或者浆细胞。
2016-06-02FDA批准首个植入性阿片成瘾药物Probuphine
Probuphine是一种皮下植入性的丁丙诺啡,由Titan制药和Braeburn制药联合研发,一次植入能够为患者释放长达六个月的低剂量丁丙诺啡。丁丙诺啡是兼具阿片受体激动和拮抗活性,低剂量能显示阿片受体的激动活性,高剂量则出现阿片受体拮抗作用。许多国家使用丁丙诺啡对阿片类毒品成瘾者进行戒毒治疗。
2016-06-02强生抗炎药SIMPONI获欧盟CHMP支持批准
Simponi于2009年上市,已获批多个适应症,包括中度至重度活动性类风湿性关节炎(RA)、活动性渐进性银屑病关节炎(PsA)、重度活动性强直性脊柱炎(AS)、中度至重度活动性溃疡性结肠炎(UC)、放射学阴性中轴型脊柱关节炎(nr-AxSpa)。
2016-06-01罗氏皮下注射剂型美罗华获欧盟批准治疗CLL
MabThera通过静脉输注(intravenous,IV)给药全程耗时约2.5小时,而皮下注射剂型MabThera通过皮下注射(subcutaneous,SC)给药,耗时仅为5分钟,而且创伤更小。这对患者及医护人员来说,均是一个显著改善,将大幅减轻治疗负担。
2016-06-01FDA授予Celator公司白血病药物Vyxeos突破性药物资格
Vyxeos是一种以5:1比例配比的标准癌症药物阿糖胞苷(cytarabine)和柔红霉素(daunorubicin)组合疗法,2种药物封装在一个纳米尺度的递送载体。Celator公司表示,这种纳米递送载体可增强疗效,同时限制了单独服用每种药物的风险。
2016-05-27risankizumab克罗恩病II期临床诱导显著缓解
risankizumab是一种单克隆抗体药物,通过特异性靶向IL-23p19亚基选择性阻断IL-23。经过12周后,risankizumab 200mg和600mg剂量组分别有24%和37%的患者达到临床缓解(无症状或非常轻微的症状),安慰剂组数据为15%。此外,risankizumab 200mg和600mg剂量组分别有15%和20%的患者达到内窥镜缓解(内窥镜检查中观察到肠道衬里正常化),安慰剂组数据仅为3%。
2016-05-27FDA批准强生降糖药INVOKAMET用于2型糖尿病一线治疗
Invokana(canagliflozin)于2013年获FDA批准,该药为日服一次的口服糖尿病药物,属于选择性钠葡萄糖共转运体2(SGLT2)抑制剂的一类新药,该类药物通过阻断肾脏对血糖的重吸收以及增加尿液中血糖的排泄,来降低机体血糖水平。与非糖尿病人群相比,2型糖尿病患者的肾脏能够重吸收大量的葡萄糖进入血液,这可能会推高血糖水平。
2016-05-27卫材在日本推出新一代抗癫痫药物Fycompa
Fycompa是由卫材内部研发的一种首创(first-in-class)的抗癫痫药物(AEDs),该药是一种高度选择性、非竞争性的AMPA型谷氨酸受体拮抗剂。谷氨酸是介导癫痫发作的主要神经递质。作为AMPA受体拮抗剂,Fycompa能通过靶向突触后AMPA受体-谷氨酸的活动,减少与癫痫发作相关神经元的过度兴奋;这种作用机制与目前市售的抗癫痫药物(AEDs)不同。
2016-05-27默克/辉瑞发布avelumab 默克尔细胞癌积极数据
默克/辉瑞发布的这项包含61名受试患者的中期临床试验结果表明,有30%此前治疗均失败的患者在使用avelumab后,肿瘤都缩小甚至消退了。
2016-05-27帕金森药物进展!新药 Xadago正式登陆英国
Xadago是一种新型单胺氧化酶B(MAO-B)选择性抑制剂,通过阻断神经元上电压依赖式钠离子通道,进而调控谷氨酸释放。推荐与左旋多巴或者其他帕金森药物合用,用于特发性帕金森病中晚期治疗。
2016-05-26诺华Zykadia获英国NICE推荐治疗ALK阳性肺癌
今年5月初,欧盟批准Zykadia用于经辉瑞靶向抗癌药Xalkori(crizotinib,克唑替尼)治疗后病情恶化的间变性淋巴瘤激酶阳性(ALK+)转移性非小细胞肺癌(NSCLC)成人患者。此次批准,使Zykadia成为欧洲既往接受Xalkori治疗失败的ALK+NSCLC患者群体的首个治疗方案,将解决这一群体中远未满足的巨大医疗需求。
2016-05-26诺和诺德糖尿病新药IDegLira如何收获FDA信任?
此次诺和诺德公司力推的IDegLira是一种结合了胰岛素药物Tresiba以及利拉鲁肽药物Victoza的联合疗法。这种每日一次的注射式疗法被认为比两种药物单独治疗的疗效更优。
2016-05-26辉瑞/诺华夹击 礼来CDK4/6新药如何脱颖而出?
研究人员指出,这一药物对于激素受体阳性类肿瘤有良好效果。这也可能是FDA授予其突破性疗法认证的重要考量。以乳腺癌为例,接受该疗法治疗的整个乳腺癌患者群体的无进展生存期为5.8个月,而激素受体阳性类癌症患者的无进展生存期则延长至8.8个月。
2016-05-25阿斯利康哮喘新药benralizumab收获巨大成功
对于早已拥挤不堪的哮喘症药物领域,临床三期研究的成功并不能成为药物大卖的充分条件。Benralizumab还需要向市场证明其效果超越现在市面上的药物。
2016-05-23Ultibro Breezhaler临床试验结果优于Seretide
诺华的全球药品研发负责人Vasant Narasimhan表示,FLAME试验表明Ultibro Breezhaler在降低患者急性发作概率方面,要优于当前的标准疗法,因此患者可以考虑将其作为吸入性类固醇的替代疗法。
2016-05-23卫材抗癌药Lenvima肾细胞癌适应症美国获批
去年,Lenvima (lenvatinib mesylate)相继在美国、欧洲、日本上市,用于治疗分化型甲状腺癌。迄今为止已经治疗了约900名患者,2016年第一季度销售额为13亿日元(约1200万美元)。
2016-05-18FDA批准Lenvatinib+依维莫司联合治疗晚期肾癌
联合治疗组最常见的不良反应包括腹泻、疲劳、关节痛、肌痛、食欲下降、呕吐、恶心、口腔炎、口腔炎症、高血压、外周水肿、咳嗽、腹痛、呼吸困难、皮疹、体重下降、出血和蛋白尿。
2016-05-18喜大普奔!百时美两款肿瘤免疫疗法欧洲获批!
与此同时,欧盟委员会还批准了Opdivo+Yervoy组合疗法用于治疗成人晚期黑色素瘤。这次批准主要是基于一项名为CheckMate-067的积极顶线数据。数据显示,和仅使用Yervoy相比,使用Opdivo+Yervoy组合疗法的患者无进展生存期取得显着延长。
2016-05-16免疫疗法Opdivo肺癌适应症再遭英国NICE拒绝
去年12月,NICE就打算在指南的草案中拒绝推荐Opdivo,然而百时美希望能够进一步交涉,从而说服NICE。但是以目前的局面看显然事与愿违。这次NICE发布的意见并不是最终决定,还要经过长达四周的咨询阶段,最终决议将在6月3日发布。然而以当前的形势看来,NICE是下定决心要和百时美就折扣方面一争到底。
2016-05-16selumetinib甲状腺癌适应症获授予孤儿药资格认定
Selumetinib是一种MEK 1/2抑制剂,目前在KRAS突变的晚期非小细胞肺癌中处于III期临床试验阶段,在儿童和青少年1型多发性神经纤维瘤中处于II期临床试验阶段。
2016-05-16GSK红斑狼疮药物Benlysta获英国NICE批准
NICE最近起草的指南表示,Benlysta(贝利木单抗)可以被纳入国民医疗保险服务,但是需要葛兰素史克和NHS之间达成一定的折扣协议,并且在药物的有效性上,还有一些问题需要更多的数据来支撑。
2016-05-12重磅!卫材脂肪肉瘤药物Halaven欧洲获批
Halaven是一种软海绵素类(halichondrin)微管动力学抑制剂,作为该抑制剂类型的唯一单药化疗药物,由卫材内部发现和开发,于2010年首次获FDA批准用于转移性乳腺癌的治疗。目前,Halaven已获日本、欧洲、美国等全球约60个国家批准。
2016-05-10
 特瑞普利单抗获批黑色素瘤一线治疗,为全人群提供系统化解决方案
特瑞普利单抗获批黑色素瘤一线治疗,为全人群提供系统化解决方案 强生宣布锐珂(埃万妥单抗注射液)联合化疗方案在华获批用于EGFR TKI经治后局部晚期或转移性非小细胞肺癌患者治疗
强生宣布锐珂(埃万妥单抗注射液)联合化疗方案在华获批用于EGFR TKI经治后局部晚期或转移性非小细胞肺癌患者治疗 荃科得联合氟维司群在华获批用于HR阳性晚期乳腺癌患者
荃科得联合氟维司群在华获批用于HR阳性晚期乳腺癌患者 伟立瑞在华获批用于治疗成人全身型重症肌无力患者
伟立瑞在华获批用于治疗成人全身型重症肌无力患者 千亿GLP-1市场再添重磅产品!华东医药司美格鲁肽注射液国内上市申请获受理
千亿GLP-1市场再添重磅产品!华东医药司美格鲁肽注射液国内上市申请获受理 优时比全身型重症肌无力药物优迪革在华获批,加速战略转型与罕见病领域布局
优时比全身型重症肌无力药物优迪革在华获批,加速战略转型与罕见病领域布局 最新临床试验表明:英飞凡免疫疗法的中国患者临床获益趋势与全球患者一致
最新临床试验表明:英飞凡免疫疗法的中国患者临床获益趋势与全球患者一致 康可期在华获批用于未经治疗的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者
康可期在华获批用于未经治疗的慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者 阿斯利康呼吸领域首款生物制剂在华上市,用于重度嗜酸粒细胞性哮喘(SEA)的维持治疗
阿斯利康呼吸领域首款生物制剂在华上市,用于重度嗜酸粒细胞性哮喘(SEA)的维持治疗 吉利德宣布拓达维新适应症在中国获批,用于治疗转移性HR+/HER2-乳腺癌患者
吉利德宣布拓达维新适应症在中国获批,用于治疗转移性HR+/HER2-乳腺癌患者 全球首发!强生旗下特诺雅达、特诺雅获批成为中国首个用于克罗恩病的白介素23抑制剂
全球首发!强生旗下特诺雅达、特诺雅获批成为中国首个用于克罗恩病的白介素23抑制剂 赛诺菲抗CD38单抗赛可益在中国获批一线适应症
赛诺菲抗CD38单抗赛可益在中国获批一线适应症 全球首个口服GLP-1RA诺和忻在中国全面上市
全球首个口服GLP-1RA诺和忻在中国全面上市 首个用于治疗FGFR基因变异局部晚期或转移性尿路上皮癌患者 的靶向药物博珂(厄达替尼片)在华获批
首个用于治疗FGFR基因变异局部晚期或转移性尿路上皮癌患者 的靶向药物博珂(厄达替尼片)在华获批 填补市场空白,呼吸道感染康复期用药“益气清肺颗粒”获批上市
填补市场空白,呼吸道感染康复期用药“益气清肺颗粒”获批上市 葛兰素史克HIV暴露前预防长效药物艾普特(卡替拉韦注射液)在中国上市
葛兰素史克HIV暴露前预防长效药物艾普特(卡替拉韦注射液)在中国上市 拜耳诺倍戈(达罗他胺片)第三项适应症注册申请获NMPA受理,实现新适应症全球同步递交
拜耳诺倍戈(达罗他胺片)第三项适应症注册申请获NMPA受理,实现新适应症全球同步递交 赛诺菲血液肿瘤药物抗CD38单抗赛可益在华获批
赛诺菲血液肿瘤药物抗CD38单抗赛可益在华获批  利普卓在我国获批用于gBRCA突变HER2阴性早期高风险乳腺癌的辅助治疗
利普卓在我国获批用于gBRCA突变HER2阴性早期高风险乳腺癌的辅助治疗 华东医药重组A型肉毒毒素上市申请获国家药品监督管理局受理
华东医药重组A型肉毒毒素上市申请获国家药品监督管理局受理 罗氏又一款CD20/CD3双特异性抗体中国获批 T细胞疗法将给复发难治性滤泡性淋巴瘤带来临床新选择
罗氏又一款CD20/CD3双特异性抗体中国获批 T细胞疗法将给复发难治性滤泡性淋巴瘤带来临床新选择 雅培亮相第七届进博会 以创意健康空间 展创新生命科技
雅培亮相第七届进博会 以创意健康空间 展创新生命科技 “中国同创”项目首个成果进博首展!全球首个胰岛素周制剂诺和期月底上市
“中国同创”项目首个成果进博首展!全球首个胰岛素周制剂诺和期月底上市 礼来首个且唯一非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)在中国获批
礼来首个且唯一非共价(可逆)BTK抑制剂捷帕力(匹妥布替尼)在中国获批 云顶新耀肾病核心产品耐赋康再添重磅利好 将推动商业化预期上升
云顶新耀肾病核心产品耐赋康再添重磅利好 将推动商业化预期上升 灵北偏头痛创新治疗药物艾普奈珠单抗落地粤港澳大湾区
灵北偏头痛创新治疗药物艾普奈珠单抗落地粤港澳大湾区 治疗BRCA突变转移性去势抵抗性前列腺癌的复方制剂泽倍珂在华获批
治疗BRCA突变转移性去势抵抗性前列腺癌的复方制剂泽倍珂在华获批 第一三共创新药物德力静(苯磺酸美洛加巴林片)在中国成功商业上市
第一三共创新药物德力静(苯磺酸美洛加巴林片)在中国成功商业上市 国内首个!德曲妥珠单抗推动HER2突变非小细胞肺癌精准治疗发展
国内首个!德曲妥珠单抗推动HER2突变非小细胞肺癌精准治疗发展 优时比比奇珠单抗放射学阴性中轴型脊柱关节炎新适应症获批
优时比比奇珠单抗放射学阴性中轴型脊柱关节炎新适应症获批 ESC 2024:拜耳非奈利酮显著改善常见成人心衰患者心血管结局
ESC 2024:拜耳非奈利酮显著改善常见成人心衰患者心血管结局 低磷酸酯酶症药Strensiq依托“港澳药械通”政策先行引入大湾区
低磷酸酯酶症药Strensiq依托“港澳药械通”政策先行引入大湾区 新一代ADC药物优赫得在华又一突破!第三个适应症获批用于治疗HER2阳性晚期胃癌患者
新一代ADC药物优赫得在华又一突破!第三个适应症获批用于治疗HER2阳性晚期胃癌患者 优赫得在华获批用于既往接受过治疗的 HER2 阳性晚期或转移性胃癌患者
优赫得在华获批用于既往接受过治疗的 HER2 阳性晚期或转移性胃癌患者  远离疼痛 更静一步:德力静上市,为DPNP患者带来更多长期获益
远离疼痛 更静一步:德力静上市,为DPNP患者带来更多长期获益 优时比倍捷乐强直性脊柱炎适应证获批上市,患者迎来治疗新突破
优时比倍捷乐强直性脊柱炎适应证获批上市,患者迎来治疗新突破 拜耳达罗他胺达到转移性激素敏感性前列腺癌患者III期ARANOTE试验的主要终点
拜耳达罗他胺达到转移性激素敏感性前列腺癌患者III期ARANOTE试验的主要终点 元羿生物泽元安(加那索龙口服混悬剂)获批,CDKL5缺乏症患者治疗重燃希望
元羿生物泽元安(加那索龙口服混悬剂)获批,CDKL5缺乏症患者治疗重燃希望 德力静(苯磺酸美洛加巴林片)获批成人糖尿病性周围神经病理性疼痛适应症 开启“糖痛”管理治疗新格局!
德力静(苯磺酸美洛加巴林片)获批成人糖尿病性周围神经病理性疼痛适应症 开启“糖痛”管理治疗新格局! 礼来Kisunla获美国FDA批准用于治疗早期症状性阿尔茨海默病
礼来Kisunla获美国FDA批准用于治疗早期症状性阿尔茨海默病 全球首个三代EGFR-TKI肺癌靶向药物泰瑞沙联合化疗一线治疗EGFR突变晚期非小细胞肺癌的适应症在中国获批
全球首个三代EGFR-TKI肺癌靶向药物泰瑞沙联合化疗一线治疗EGFR突变晚期非小细胞肺癌的适应症在中国获批 首个治疗多发性骨髓瘤的BCMA×CD3双抗泰立珂在华获批
首个治疗多发性骨髓瘤的BCMA×CD3双抗泰立珂在华获批 Isa-Pd联合疗法真实世界研究数据亮相EHA,复发或难治性多发性骨髓瘤客观缓解率达82.6%
Isa-Pd联合疗法真实世界研究数据亮相EHA,复发或难治性多发性骨髓瘤客观缓解率达82.6% 诺华创新药飞赫达在华获批开创PNH靶向治疗新时代,“跑步入场”惠及中国患者
诺华创新药飞赫达在华获批开创PNH靶向治疗新时代,“跑步入场”惠及中国患者 欧洲监管机构建议批准Awiqli(基础胰岛素周制剂依柯胰岛素)用于治疗糖尿病
欧洲监管机构建议批准Awiqli(基础胰岛素周制剂依柯胰岛素)用于治疗糖尿病 中国12岁及以上青少年AD患者可用“突破性疗法”, 希必可青少年新适应症正式获批
中国12岁及以上青少年AD患者可用“突破性疗法”, 希必可青少年新适应症正式获批 武田创新药物替度格鲁肽中国获批! 改写“短肠人”被输液袋困住的命运
武田创新药物替度格鲁肽中国获批! 改写“短肠人”被输液袋困住的命运 Datopotamab deruxtecan 生物制品许可申请在美国被受理, 用于既往接受过治疗的晚期非鳞状非小细胞肺癌患者
Datopotamab deruxtecan 生物制品许可申请在美国被受理, 用于既往接受过治疗的晚期非鳞状非小细胞肺癌患者 全新机制抗病毒药物马立巴韦片开出全国首处方, 填补移植后难治性CMV临床治疗空白
全新机制抗病毒药物马立巴韦片开出全国首处方, 填补移植后难治性CMV临床治疗空白 全新一代CGRP受体拮抗剂乐泰可在中国获批 开启偏头痛特异性治疗口服靶向药新时代
全新一代CGRP受体拮抗剂乐泰可在中国获批 开启偏头痛特异性治疗口服靶向药新时代 新可来(美泊利珠单抗注射液)在中国获批用于治疗重度嗜酸粒细胞性哮喘
新可来(美泊利珠单抗注射液)在中国获批用于治疗重度嗜酸粒细胞性哮喘 阿尔茨海默病治疗新希望,全球首款阿尔茨海默病靶向药乐意保(仑卡奈单抗)在中国获批
阿尔茨海默病治疗新希望,全球首款阿尔茨海默病靶向药乐意保(仑卡奈单抗)在中国获批  首个呼吸道合胞病毒预防手段在华获批!打一针即可保护婴儿度过合胞病毒危险期
首个呼吸道合胞病毒预防手段在华获批!打一针即可保护婴儿度过合胞病毒危险期 开启“除幽”新篇章!武田富马酸伏诺拉生片根除幽门螺杆菌新适应症在中国获批
开启“除幽”新篇章!武田富马酸伏诺拉生片根除幽门螺杆菌新适应症在中国获批 重磅!欧唐静(恩格列净)成人慢性肾病适应症在华获批
重磅!欧唐静(恩格列净)成人慢性肾病适应症在华获批 君实生物新冠口服药民得维第2项三期研究结果荣登《柳叶刀-感染病学》
君实生物新冠口服药民得维第2项三期研究结果荣登《柳叶刀-感染病学》 成人2型糖尿病复方制剂安达释正式在华上市 为中国糖尿病患者带来控糖护心肾治疗新选择
成人2型糖尿病复方制剂安达释正式在华上市 为中国糖尿病患者带来控糖护心肾治疗新选择 创新治疗药物兆珂速在华上市 开启多发性骨髓瘤治疗新格局
创新治疗药物兆珂速在华上市 开启多发性骨髓瘤治疗新格局 广东多家医院高水平通过FDA核查,助力中国首个自研自产创新生物药成功出海
广东多家医院高水平通过FDA核查,助力中国首个自研自产创新生物药成功出海 “免疫+靶向”联合治疗新突破 有望改变中国人群RCC一线治疗标准
“免疫+靶向”联合治疗新突破 有望改变中国人群RCC一线治疗标准 舒立瑞在华获批治疗成人视神经脊髓炎谱系疾病
舒立瑞在华获批治疗成人视神经脊髓炎谱系疾病 阿贝西利片扩展适应症在华获批,惠及更多高危早期乳腺癌患者
阿贝西利片扩展适应症在华获批,惠及更多高危早期乳腺癌患者 安达释在我国获批用于治疗成人2型糖尿病
安达释在我国获批用于治疗成人2型糖尿病 Survodutide(BI 456906)II期试验显示,超重或肥胖受试者体重下降接近19%
Survodutide(BI 456906)II期试验显示,超重或肥胖受试者体重下降接近19%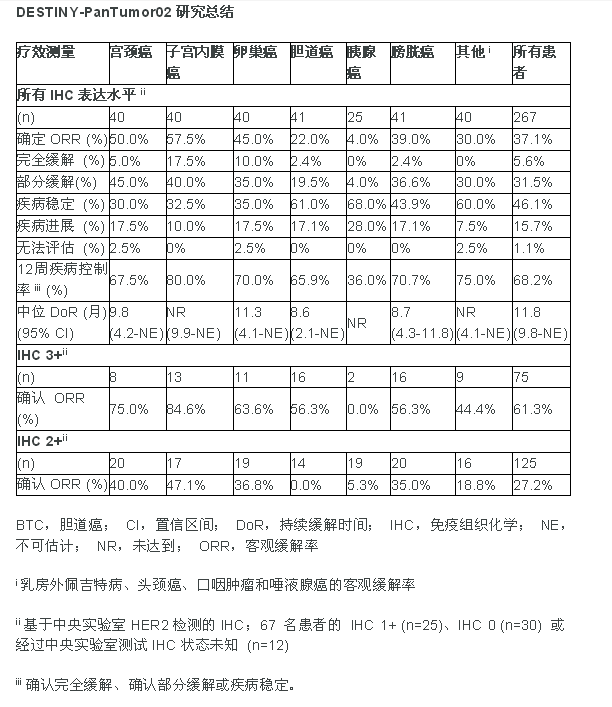 优赫得在多个HER2表达的晚期实体瘤患者中表现临床意义和持续缓解
优赫得在多个HER2表达的晚期实体瘤患者中表现临床意义和持续缓解 美泊利珠单抗治疗重度嗜酸粒细胞性哮喘的中国III期研究数据表现积极
美泊利珠单抗治疗重度嗜酸粒细胞性哮喘的中国III期研究数据表现积极 拜耳非奈利酮获批可用于与2型糖尿病相关慢性肾脏病早期人群
拜耳非奈利酮获批可用于与2型糖尿病相关慢性肾脏病早期人群 中国首部《青少年成人脊髓性肌萎缩症临床诊疗指南》正式发布
中国首部《青少年成人脊髓性肌萎缩症临床诊疗指南》正式发布 进口原研13价肺炎球菌结合疫苗扩年龄新适应症正式获批!
进口原研13价肺炎球菌结合疫苗扩年龄新适应症正式获批! 拜耳诺倍戈激素敏感性前列腺癌国内获批,前列腺癌适应症进一步拓宽
拜耳诺倍戈激素敏感性前列腺癌国内获批,前列腺癌适应症进一步拓宽 诺倍戈(达罗他胺)新适应症欧盟获批 转移性激素敏感性前列腺癌患者将获益
诺倍戈(达罗他胺)新适应症欧盟获批 转移性激素敏感性前列腺癌患者将获益 新一代ADC药物优赫得在华获批,晚期乳腺癌迎来治疗新希望!
新一代ADC药物优赫得在华获批,晚期乳腺癌迎来治疗新希望! 《新英格兰医学杂志》发表口服抗新冠病毒药物VV116对比PAXLOVID治疗伴有高风险因素的轻/中度COVID-19患者III期临床研究结果
《新英格兰医学杂志》发表口服抗新冠病毒药物VV116对比PAXLOVID治疗伴有高风险因素的轻/中度COVID-19患者III期临床研究结果 Capivasertib联合芙仕得与芙仕得相比降低晚期HR阳性乳腺癌40%的疾病进展或死亡风险
Capivasertib联合芙仕得与芙仕得相比降低晚期HR阳性乳腺癌40%的疾病进展或死亡风险 Enhertu在DESTINY-Breast03中延长HER2阳性转移性乳腺癌统计学意义上总生存,比T-DM1降低死亡风险36%
Enhertu在DESTINY-Breast03中延长HER2阳性转移性乳腺癌统计学意义上总生存,比T-DM1降低死亡风险36% 莫格利珠单抗在中国获批,用于治疗复发或难治性Sézary综合征或晚期蕈样肉芽肿
莫格利珠单抗在中国获批,用于治疗复发或难治性Sézary综合征或晚期蕈样肉芽肿 最新研究数据显示:重组带状疱疹疫苗欣安立适能够为50岁及以上成人提供至少10年的保护
最新研究数据显示:重组带状疱疹疫苗欣安立适能够为50岁及以上成人提供至少10年的保护 全球首创降糖新药华堂宁获批, 拜耳建立糖尿病全病程管理模式
全球首创降糖新药华堂宁获批, 拜耳建立糖尿病全病程管理模式 利普卓在中国获批与贝伐珠单抗联合用于HRD阳性晚期卵巢癌一线维持治疗
利普卓在中国获批与贝伐珠单抗联合用于HRD阳性晚期卵巢癌一线维持治疗 特瑞普利单抗联合化疗用于一线治疗肺癌患者获得国家药品监督管理局批准
特瑞普利单抗联合化疗用于一线治疗肺癌患者获得国家药品监督管理局批准 阿柏西普8毫克制剂首次达到在89%的患者中延长注射间隔达16周
阿柏西普8毫克制剂首次达到在89%的患者中延长注射间隔达16周 用于治疗成年中重度斑块状银屑病患者的口服药物获美国FDA批准
用于治疗成年中重度斑块状银屑病患者的口服药物获美国FDA批准 达格列净慢性肾脏病适应症在中国获批
达格列净慢性肾脏病适应症在中国获批 重磅!欧唐静(恩格列净片)在华获批射血分数保留的成人心力衰竭适应症
重磅!欧唐静(恩格列净片)在华获批射血分数保留的成人心力衰竭适应症 阿斯利康中国首个罕见病药物舒立瑞在华收获里程碑进展,为罕见病治疗提供新选择
阿斯利康中国首个罕见病药物舒立瑞在华收获里程碑进展,为罕见病治疗提供新选择 Enhertu在美国获批作为首个针对HER2低表达转移性乳腺癌患者的 HER2靶向疗法
Enhertu在美国获批作为首个针对HER2低表达转移性乳腺癌患者的 HER2靶向疗法 泛肿瘤TRK抑制剂罗圣全在中国获批,开启个体化医疗新篇章
泛肿瘤TRK抑制剂罗圣全在中国获批,开启个体化医疗新篇章 骨髓瘤迎来新药,塞利尼索片中国上市
骨髓瘤迎来新药,塞利尼索片中国上市 全球首款FcRn拮抗剂国内上市申请获受理,用于治疗全身型重症肌无力
全球首款FcRn拮抗剂国内上市申请获受理,用于治疗全身型重症肌无力 非奈利酮片获批上市,用于与2型糖尿病相关的慢性肾脏病
非奈利酮片获批上市,用于与2型糖尿病相关的慢性肾脏病 百时美施贵宝PD-1抑制剂新增两项食管癌新适应证
百时美施贵宝PD-1抑制剂新增两项食管癌新适应证 拉罗替尼口服溶液国内获批,NTRK基因融合实体瘤儿童重获新生不再是梦想
拉罗替尼口服溶液国内获批,NTRK基因融合实体瘤儿童重获新生不再是梦想 PD-1抑制剂达伯舒一线治疗胃腺癌适应症获批上市
PD-1抑制剂达伯舒一线治疗胃腺癌适应症获批上市 达伯舒联合化疗用于一线治疗食管鳞癌 获得国家药品监督管理局批准上市
达伯舒联合化疗用于一线治疗食管鳞癌 获得国家药品监督管理局批准上市 多城联动,急性白血病新药贝博萨在中国上市
多城联动,急性白血病新药贝博萨在中国上市 渤健多发性硬化高峰论坛暨氨吡啶缓释片上市会今日召开
渤健多发性硬化高峰论坛暨氨吡啶缓释片上市会今日召开 白血病告别化疗?Calquence联合奥妥珠单抗患者5年生存率达到90%
白血病告别化疗?Calquence联合奥妥珠单抗患者5年生存率达到90% 为肺纤维化按下暂停键!新型PDE4B抑制剂可显著延缓IPF患者肺功能下降
为肺纤维化按下暂停键!新型PDE4B抑制剂可显著延缓IPF患者肺功能下降 美国FDA接受达罗他胺联合多西他赛治疗转移性激素敏感性前列腺癌的补充新药申请
美国FDA接受达罗他胺联合多西他赛治疗转移性激素敏感性前列腺癌的补充新药申请 肺癌创新药第三代ALK抑制剂博瑞纳在中国获批
肺癌创新药第三代ALK抑制剂博瑞纳在中国获批 中国首款自研P-CAB替戈拉生片获批 开启抑酸治疗新时代
中国首款自研P-CAB替戈拉生片获批 开启抑酸治疗新时代 又有一新药获批!泛癌种患者多了新选择!
又有一新药获批!泛癌种患者多了新选择! 狼疮肾炎迎靶向治疗时代,首款狼疮肾炎的生物制剂在中国上市
狼疮肾炎迎靶向治疗时代,首款狼疮肾炎的生物制剂在中国上市 快速终止癫痫发作!优时比阿普唑仑创新吸入式疗法纳入突破性治疗品种
快速终止癫痫发作!优时比阿普唑仑创新吸入式疗法纳入突破性治疗品种 解决耐药问题!ALK阳性晚期非小细胞肺癌患者迎来全新治疗选择
解决耐药问题!ALK阳性晚期非小细胞肺癌患者迎来全新治疗选择 新的独立研究显示Evusheld长效抗体组合药物对包括BA.2在内的奥密克戎变异株具有中和活性
新的独立研究显示Evusheld长效抗体组合药物对包括BA.2在内的奥密克戎变异株具有中和活性 多发性硬化突破性创新药在华开出首张处方
多发性硬化突破性创新药在华开出首张处方 赛诺菲抗心律失常创新药物迈达龙在华上市,开启中国房颤治疗新局面
赛诺菲抗心律失常创新药物迈达龙在华上市,开启中国房颤治疗新局面 关注肺癌患者治疗,肺癌创新药卡马替尼落地大湾区
关注肺癌患者治疗,肺癌创新药卡马替尼落地大湾区 儿童静脉血栓栓塞症有了新疗法,拜瑞妥在中国获批新适应症
儿童静脉血栓栓塞症有了新疗法,拜瑞妥在中国获批新适应症 阿贝西利片开启HR+, HER2-早期乳腺癌高危患者辅助治疗新时代
阿贝西利片开启HR+, HER2-早期乳腺癌高危患者辅助治疗新时代 肿瘤新药在博鳌乐城落地, 加速惠及HER2阳性乳腺癌及胃癌患者
肿瘤新药在博鳌乐城落地, 加速惠及HER2阳性乳腺癌及胃癌患者 首个中国原研CDK4/6抑制剂羟乙磺酸达尔西利片开出首日处方 为我国乳腺癌患者带来生命福音
首个中国原研CDK4/6抑制剂羟乙磺酸达尔西利片开出首日处方 为我国乳腺癌患者带来生命福音 适用人群再拓宽 特应性皮炎靶向生物制剂达必妥在华获批儿童适应症
适用人群再拓宽 特应性皮炎靶向生物制剂达必妥在华获批儿童适应症 前列腺癌一线治疗!奥拉帕利联合疗法显著降低疾病进展风险达34%
前列腺癌一线治疗!奥拉帕利联合疗法显著降低疾病进展风险达34% 一周一次重磅降糖新药诺和泰现可医保报销,惠及中国2型糖尿病患者
一周一次重磅降糖新药诺和泰现可医保报销,惠及中国2型糖尿病患者 康新博成为我国目前唯一可同时治疗成人患者侵袭性毛霉病和曲霉病的口服抗真菌药物
康新博成为我国目前唯一可同时治疗成人患者侵袭性毛霉病和曲霉病的口服抗真菌药物 心血管创新药阿利西尤单抗迎来医保落地,惠及心血管患者
心血管创新药阿利西尤单抗迎来医保落地,惠及心血管患者 新年新医保,银屑病患者收获全国首批医保处方
新年新医保,银屑病患者收获全国首批医保处方 新版医保目录执行!乌司奴单抗等药品医保首方纷纷开出
新版医保目录执行!乌司奴单抗等药品医保首方纷纷开出 中国首个三代BCR-ABL 抑制剂开出首批处方,多家医院落地惠及患者
中国首个三代BCR-ABL 抑制剂开出首批处方,多家医院落地惠及患者 急性白血病 “破局者”! 创新药贝博萨在中国获批
急性白血病 “破局者”! 创新药贝博萨在中国获批 “港澳药械通”造福民众 乳腺癌创新药Alpelisib获批引进粤港澳大湾区
“港澳药械通”造福民众 乳腺癌创新药Alpelisib获批引进粤港澳大湾区 全球首款FcRn拮抗剂efgartigimod获美国FDA批准用于治疗全身型重症肌无力
全球首款FcRn拮抗剂efgartigimod获美国FDA批准用于治疗全身型重症肌无力 国内首个针对成人侵袭性毛霉病的口服抗真菌药物正式获批
国内首个针对成人侵袭性毛霉病的口服抗真菌药物正式获批 放宽接种时间 全球首款双载体13价肺炎疫苗上市
放宽接种时间 全球首款双载体13价肺炎疫苗上市 中国患者率先获益,特瑞普利单抗一线治疗鼻咽癌适应症获批
中国患者率先获益,特瑞普利单抗一线治疗鼻咽癌适应症获批 新III 期临床研究启动评估维立西呱在射血分数降低慢性心衰患者中的应用
新III 期临床研究启动评估维立西呱在射血分数降低慢性心衰患者中的应用 美国肾脏病学会发布新数据 强化非奈利酮在慢性肾病伴2型糖尿病患者中的肾脏和心血管获益
美国肾脏病学会发布新数据 强化非奈利酮在慢性肾病伴2型糖尿病患者中的肾脏和心血管获益 全球首个原发性轻链型淀粉样变治疗药物兆珂速在华获批
全球首个原发性轻链型淀粉样变治疗药物兆珂速在华获批 信迪利单抗联合化疗一线治疗胃癌临床研究数据公布
信迪利单抗联合化疗一线治疗胃癌临床研究数据公布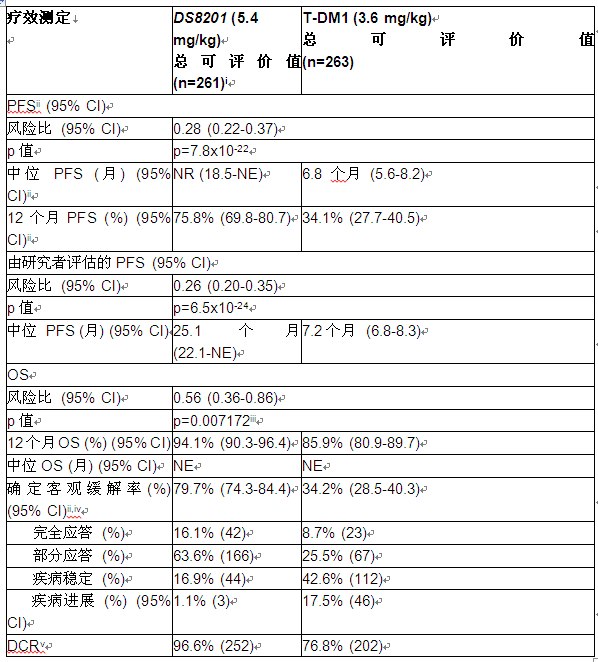 HER-2阳性乳腺癌:Enhertu与T-DM1相比,可降低死亡风险72%
HER-2阳性乳腺癌:Enhertu与T-DM1相比,可降低死亡风险72% 新研究证实达罗他胺显著提高非转移性前列腺癌患者整体生存质量
新研究证实达罗他胺显著提高非转移性前列腺癌患者整体生存质量 英飞凡联合化疗可3倍提升广泛期小细胞肺癌患者3年生存率
英飞凡联合化疗可3倍提升广泛期小细胞肺癌患者3年生存率 新数据证实!非奈利酮可改善慢性肾病合并2型糖尿病患者的心血管结局
新数据证实!非奈利酮可改善慢性肾病合并2型糖尿病患者的心血管结局 中国银屑病患者迎来新口服药物 欧泰乐在华获批
中国银屑病患者迎来新口服药物 欧泰乐在华获批 多发性硬化迎来新药 短期改善行走功能,长期延缓疾病进展
多发性硬化迎来新药 短期改善行走功能,长期延缓疾病进展 新一代血友病药物在我国上市,可有效降低抑制物形成
新一代血友病药物在我国上市,可有效降低抑制物形成 慢性肾病患者福音,降磷药诺维乐国内获批
慢性肾病患者福音,降磷药诺维乐国内获批 糖尿病肾病患者再添“利器”,又一新药获批上市
糖尿病肾病患者再添“利器”,又一新药获批上市 10年来高血压迎来新药 沙库巴曲缬沙坦被证实降压更有效
10年来高血压迎来新药 沙库巴曲缬沙坦被证实降压更有效 利伐沙班+阿司匹林新型抗栓方案再添新证据
利伐沙班+阿司匹林新型抗栓方案再添新证据 血友病新药在华获批!A型血友病患者有望实现“零出血”
血友病新药在华获批!A型血友病患者有望实现“零出血” 突破传统化疗局限,PARP抑制剂帕米帕利开启复发性卵巢癌治疗新时代
突破传统化疗局限,PARP抑制剂帕米帕利开启复发性卵巢癌治疗新时代 兼顾降糖与护心,一周一次重磅降糖药在中国获批
兼顾降糖与护心,一周一次重磅降糖药在中国获批 针对复发或难治性多发性骨髓瘤患者 创新靶向药物在我国获批
针对复发或难治性多发性骨髓瘤患者 创新靶向药物在我国获批 全病程只需口服一次!这款“全新作用机制”抗流感新药正式获批
全病程只需口服一次!这款“全新作用机制”抗流感新药正式获批 “双艾”方案,为肝癌患者带来“治疗奇迹”
“双艾”方案,为肝癌患者带来“治疗奇迹” 我国自主研发治疗系统性红斑狼疮的创新药物上市
我国自主研发治疗系统性红斑狼疮的创新药物上市 中国获批上市!多发性硬化患者等来又一新药
中国获批上市!多发性硬化患者等来又一新药 晚期或转移性尿路上皮癌患者或将迎来“新”的突破口
晚期或转移性尿路上皮癌患者或将迎来“新”的突破口 遗传性血管性水肿有了新药,这种罕见病发作严重可致死亡
遗传性血管性水肿有了新药,这种罕见病发作严重可致死亡 肿瘤免疫治疗患者未来可以6周用药一次,覆盖多个瘤种
肿瘤免疫治疗患者未来可以6周用药一次,覆盖多个瘤种 50%双相情感障碍患者被误诊为抑郁症,患者获新药选择
50%双相情感障碍患者被误诊为抑郁症,患者获新药选择 EGFR突变阳性晚期非小细胞肺癌 我国新药取新突破
EGFR突变阳性晚期非小细胞肺癌 我国新药取新突破 全球首个鼻咽癌免疫疗法获批,晚期鼻咽癌获更长生存期
全球首个鼻咽癌免疫疗法获批,晚期鼻咽癌获更长生存期 及早治疗可降低年复发率近80%,北京市特应性皮炎诊疗地图出炉
及早治疗可降低年复发率近80%,北京市特应性皮炎诊疗地图出炉 短效β-受体激动剂已过时?轻度哮喘有了新药物
短效β-受体激动剂已过时?轻度哮喘有了新药物 活动性狼疮性肾炎患者首款新药获批上市
活动性狼疮性肾炎患者首款新药获批上市 世界艾滋病大会公布新型HIV药物多拉韦林最新研究成果
世界艾滋病大会公布新型HIV药物多拉韦林最新研究成果 帕博利珠单抗获批食管癌治疗,中国食管癌免疫治疗正式开启
帕博利珠单抗获批食管癌治疗,中国食管癌免疫治疗正式开启 塞瑞替尼新添适应症,入局ALK阳性非小细胞肺癌一线治疗
塞瑞替尼新添适应症,入局ALK阳性非小细胞肺癌一线治疗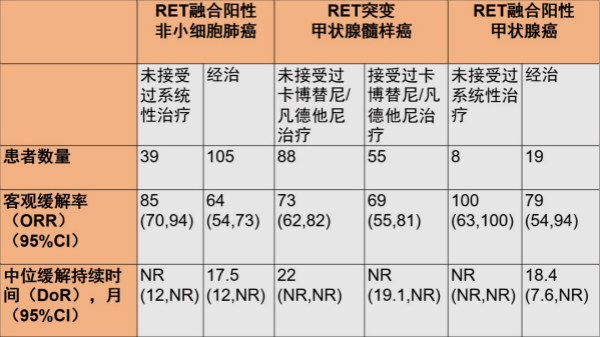 礼来Retevmo获FDA批准成为首个针对RET驱动基因晚期肺癌和甲状腺癌患者疗法
礼来Retevmo获FDA批准成为首个针对RET驱动基因晚期肺癌和甲状腺癌患者疗法 替雷利珠单抗注射液联合化疗治疗一线晚期鳞状非小细胞肺癌患者3期临床数据首次披露
替雷利珠单抗注射液联合化疗治疗一线晚期鳞状非小细胞肺癌患者3期临床数据首次披露 诺华多发性硬化又一重磅创新药万立能(西尼莫德)中国获批
诺华多发性硬化又一重磅创新药万立能(西尼莫德)中国获批 信迪利单抗联合吉西他滨和铂类一线治疗鳞状非小细胞肺癌,显著延长无进展生存期
信迪利单抗联合吉西他滨和铂类一线治疗鳞状非小细胞肺癌,显著延长无进展生存期 罗氏免疫治疗药物泰圣奇在华上市,打破小细胞肺癌治疗30年困局
罗氏免疫治疗药物泰圣奇在华上市,打破小细胞肺癌治疗30年困局 诺华可善挺(司库奇尤单抗)强直性脊柱炎适应症获批
诺华可善挺(司库奇尤单抗)强直性脊柱炎适应症获批 FDA批准克立硼罗软膏轻度至中度特应性皮炎儿童扩展适应症补充新药申请
FDA批准克立硼罗软膏轻度至中度特应性皮炎儿童扩展适应症补充新药申请 赛诺菲巴斯德四价脑膜炎球菌结合疫苗在美获批 为2岁及以上人群提供保护
赛诺菲巴斯德四价脑膜炎球菌结合疫苗在美获批 为2岁及以上人群提供保护 中国黑色素瘤双靶联合治疗方案开出首张处方,全国37个城市正式上市
中国黑色素瘤双靶联合治疗方案开出首张处方,全国37个城市正式上市 国家药品监督管理局受理胃肠道间质瘤精准靶向药avapritinib两个适应症上市申请
国家药品监督管理局受理胃肠道间质瘤精准靶向药avapritinib两个适应症上市申请 新研究:骨科非大手术后主要静脉血栓栓塞发生风险使用利伐沙班后可降75%
新研究:骨科非大手术后主要静脉血栓栓塞发生风险使用利伐沙班后可降75% 阿柏西普与单抗的间接比较结果公布:两年内阿柏西普所需注射省六针
阿柏西普与单抗的间接比较结果公布:两年内阿柏西普所需注射省六针 心衰在研新药Vericiguat达到III期临床首要终点
心衰在研新药Vericiguat达到III期临床首要终点 阿斯利康度伐利尤单抗获FDA批准用于治疗广泛期小细胞肺癌
阿斯利康度伐利尤单抗获FDA批准用于治疗广泛期小细胞肺癌  基石药业在台湾递交胃肠道间质瘤精准靶向药物avapritinib上市申请
基石药业在台湾递交胃肠道间质瘤精准靶向药物avapritinib上市申请  豪森药业获批全球第二个三代EGFR-TKI创新药阿美乐(甲磺酸阿美替尼片)
豪森药业获批全球第二个三代EGFR-TKI创新药阿美乐(甲磺酸阿美替尼片) 喜达诺(乌司奴单抗)再获新适应症 成人克罗恩病治疗进入白介素新时代
喜达诺(乌司奴单抗)再获新适应症 成人克罗恩病治疗进入白介素新时代 默克西妥昔单抗添新适应症,获批一线治疗头颈部鳞癌
默克西妥昔单抗添新适应症,获批一线治疗头颈部鳞癌 我国首个自主创新13价肺炎球菌多糖结合疫苗沃安欣获批
我国首个自主创新13价肺炎球菌多糖结合疫苗沃安欣获批 肺癌创新药二代ALK抑制剂CT-707将上市
肺癌创新药二代ALK抑制剂CT-707将上市 用于治疗中重度斑块状银屑病成人患者的靶向白细胞介素23抑制剂特诺雅(古塞奇尤单抗)在华获批
用于治疗中重度斑块状银屑病成人患者的靶向白细胞介素23抑制剂特诺雅(古塞奇尤单抗)在华获批 全程靶向治疗“从早到晚” 实现HER2阳性乳腺癌诊疗慢病化管理
全程靶向治疗“从早到晚” 实现HER2阳性乳腺癌诊疗慢病化管理 肿瘤免疫治疗新选择,百济神州PD-1替雷利珠单抗正式获批上市
肿瘤免疫治疗新选择,百济神州PD-1替雷利珠单抗正式获批上市 肢端肥大症治疗药物醋酸兰瑞肽缓释注射液(预充式)正式获批
肢端肥大症治疗药物醋酸兰瑞肽缓释注射液(预充式)正式获批 阿斯利康慢阻肺三联新药布地格福吸入气雾剂中国获批,显著降低急性加重率
阿斯利康慢阻肺三联新药布地格福吸入气雾剂中国获批,显著降低急性加重率 Enhertu在美国获批用于治疗HER2阳性无法切除或转移性乳腺癌患者
Enhertu在美国获批用于治疗HER2阳性无法切除或转移性乳腺癌患者 狼疮性肾炎患者新希望,贝利尤单抗治疗狼疮性肾炎患者的III期临床试验新进展
狼疮性肾炎患者新希望,贝利尤单抗治疗狼疮性肾炎患者的III期临床试验新进展 临床急需,国内首个法布雷病特效药物法布赞在华获批
临床急需,国内首个法布雷病特效药物法布赞在华获批 罗氏创新靶向药帕捷特又一适应症获批 开启HER2阳性晚期乳腺癌治疗新格局
罗氏创新靶向药帕捷特又一适应症获批 开启HER2阳性晚期乳腺癌治疗新格局 K药又获肺癌新适应症,食管癌已在路上
K药又获肺癌新适应症,食管癌已在路上 中国抗癌新药在美获批上市!泽布替尼,淋巴瘤治疗上的新突破
中国抗癌新药在美获批上市!泽布替尼,淋巴瘤治疗上的新突破 国内首个氨溴索雾化吸入剂易安平正式上市
国内首个氨溴索雾化吸入剂易安平正式上市 中国首个自主研发人源化抗CD25单克隆抗体开出首张处方
中国首个自主研发人源化抗CD25单克隆抗体开出首张处方 美国FDA批准利伐沙班用于内科急重症患者预防血栓
美国FDA批准利伐沙班用于内科急重症患者预防血栓 吴一龙教授和周清教授深度解读ARTEMIS(CTONG1509)研究,A+T有望成为EGFRm+ NSCLC一线治疗新标准
吴一龙教授和周清教授深度解读ARTEMIS(CTONG1509)研究,A+T有望成为EGFRm+ NSCLC一线治疗新标准 纳武利尤单抗对比化疗使晚期食管癌患者的死亡风险降低23%,中位总生存期延长2.5个月
纳武利尤单抗对比化疗使晚期食管癌患者的死亡风险降低23%,中位总生存期延长2.5个月 ESMO重磅!尼拉帕利一线维持治疗数据出炉,所有类型卵巢癌患者均获益
ESMO重磅!尼拉帕利一线维持治疗数据出炉,所有类型卵巢癌患者均获益 打破半个世纪无药困境!帕博利珠单抗食管癌亚洲数据惊艳CSCO!
打破半个世纪无药困境!帕博利珠单抗食管癌亚洲数据惊艳CSCO! 延缓前列腺癌转移 新一代雄激素受体抑制剂安森珂在华获批
延缓前列腺癌转移 新一代雄激素受体抑制剂安森珂在华获批 礼来银屑病新药拓咨(依奇珠单抗注射液)在华获批
礼来银屑病新药拓咨(依奇珠单抗注射液)在华获批 罗沙司他获批用于非透析患者肾性贫血治疗,全球首创新药扩大适用范围
罗沙司他获批用于非透析患者肾性贫血治疗,全球首创新药扩大适用范围 礼来男性健康产品希爱力(他达拉非片)新适应症正式上市
礼来男性健康产品希爱力(他达拉非片)新适应症正式上市 快速缓解口腔黏膜炎疼痛 新型口腔凝胶益普舒在中国上市
快速缓解口腔黏膜炎疼痛 新型口腔凝胶益普舒在中国上市 优时比创新药希敏佳获批 正式进军中国免疫系统疾病治疗领域
优时比创新药希敏佳获批 正式进军中国免疫系统疾病治疗领域 恒瑞获批国内首家阿比特龙仿制药 指南推荐提升患者获益
恒瑞获批国内首家阿比特龙仿制药 指南推荐提升患者获益 全球首个CD38单克隆抗体靶向药物兆珂在华获批
全球首个CD38单克隆抗体靶向药物兆珂在华获批 礼来类风湿关节炎新药艾乐明(巴瑞替尼片)在华获批
礼来类风湿关节炎新药艾乐明(巴瑞替尼片)在华获批 饿“晕”癌王!抗血管生成靶向药,开启脑癌治疗新格局
饿“晕”癌王!抗血管生成靶向药,开启脑癌治疗新格局 西安杨森每三月皮下注射一次治疗银屑病生物制剂喜达诺上市
西安杨森每三月皮下注射一次治疗银屑病生物制剂喜达诺上市 亚盛医药公布细胞凋亡系列临床产品APG-115、APG-1387最新临床数据
亚盛医药公布细胞凋亡系列临床产品APG-115、APG-1387最新临床数据 胰腺癌和卵巢癌治疗迎突破 ASCO 2019公布奥拉帕利最新研究进展
胰腺癌和卵巢癌治疗迎突破 ASCO 2019公布奥拉帕利最新研究进展 百时美施贵宝在2019ASCO年会上首次发布纳武利尤单抗联合伊匹木单抗治疗晚期肝细胞癌的临床研究结果
百时美施贵宝在2019ASCO年会上首次发布纳武利尤单抗联合伊匹木单抗治疗晚期肝细胞癌的临床研究结果 曾小峰:推进尼达尼布治疗硬化病相关的间质性肺疾病(SSc-ILD)审批,将为患者带来曙光
曾小峰:推进尼达尼布治疗硬化病相关的间质性肺疾病(SSc-ILD)审批,将为患者带来曙光 安进宣布首个骨巨细胞瘤治疗药物安加维地舒单抗在中国获批
安进宣布首个骨巨细胞瘤治疗药物安加维地舒单抗在中国获批 突破性创新型抗生素——辉瑞思福妥 (注射用头孢他啶阿维巴坦钠)在中国获批
突破性创新型抗生素——辉瑞思福妥 (注射用头孢他啶阿维巴坦钠)在中国获批 达霏欣新品在京隆重发布 倡导脱发需”男女分治”
达霏欣新品在京隆重发布 倡导脱发需”男女分治” 拜耳治疗子宫内膜异位症新药唯散宁获批上市
拜耳治疗子宫内膜异位症新药唯散宁获批上市 拜耳艾力雅治疗间期可延至3个月,其新治疗方案在中国获批
拜耳艾力雅治疗间期可延至3个月,其新治疗方案在中国获批 百济神州在研创新型BTK抑制剂定中文通用名为“泽布替尼”
百济神州在研创新型BTK抑制剂定中文通用名为“泽布替尼” 拜耳磁共振对比剂加乐显(钆布醇注射液)2岁以下儿童适应症在华获批
拜耳磁共振对比剂加乐显(钆布醇注射液)2岁以下儿童适应症在华获批 新一代造血干细胞动员剂释倍灵开出中国首张处方
新一代造血干细胞动员剂释倍灵开出中国首张处方 吃1片管5天!20年来全球首款全新机制抗流感病毒药
吃1片管5天!20年来全球首款全新机制抗流感病毒药 诺华全球重磅产品可善挺(司库奇尤单抗)在华获批2019-04-01
诺华全球重磅产品可善挺(司库奇尤单抗)在华获批2019-04-01 中国创新PD-1抑制剂达伯舒(信迪利单抗注射液)正式登陆国内市场
中国创新PD-1抑制剂达伯舒(信迪利单抗注射液)正式登陆国内市场 特应性皮炎靶向生物制剂Dupixent中国内地首针注射完成
特应性皮炎靶向生物制剂Dupixent中国内地首针注射完成 迅速缓解口腔黏膜炎疼痛 新型口腔凝胶益普舒获批上市
迅速缓解口腔黏膜炎疼痛 新型口腔凝胶益普舒获批上市 中国首个鸟苷酸环化酶激动剂令泽舒(利那洛肽)正式获批
中国首个鸟苷酸环化酶激动剂令泽舒(利那洛肽)正式获批 持续推动血友病治疗领域发展 拜耳新型重组八因子科跃奇上市
持续推动血友病治疗领域发展 拜耳新型重组八因子科跃奇上市 罗氏旗下乳腺癌创新靶向药帕捷特在中国获批
罗氏旗下乳腺癌创新靶向药帕捷特在中国获批 西安杨森泽珂在中国新适应症获批 用于治疗新诊断的高危转移性内分泌治疗敏感性前列腺癌
西安杨森泽珂在中国新适应症获批 用于治疗新诊断的高危转移性内分泌治疗敏感性前列腺癌 创新PD-1首登国际学术会议舞台自主研发惠及“中国式”肝癌
创新PD-1首登国际学术会议舞台自主研发惠及“中国式”肝癌 突破!晚期霍奇金淋巴瘤有了免疫治疗方案
突破!晚期霍奇金淋巴瘤有了免疫治疗方案 EMPRISE真实世界研究初步结果显示 恩格列净能降低患者的心衰住院风险
EMPRISE真实世界研究初步结果显示 恩格列净能降低患者的心衰住院风险 《新英格兰医学杂志》发表Praluent(alirocumab) 心血管结局研究的详细结果
《新英格兰医学杂志》发表Praluent(alirocumab) 心血管结局研究的详细结果 度拉糖肽针对广泛人群2型糖尿病患者心血管事件减少显示优效
度拉糖肽针对广泛人群2型糖尿病患者心血管事件减少显示优效 一日一贴缓解帕金森 优时比创新疗法在中国上市
一日一贴缓解帕金森 优时比创新疗法在中国上市 赛诺菲又一儿童创新药物法舒克在华获批
赛诺菲又一儿童创新药物法舒克在华获批 再鼎医药宣布则在香港获批,用于复发性卵巢癌的治疗
再鼎医药宣布则在香港获批,用于复发性卵巢癌的治疗 乐瑞卡新适应症在华获批上市 填补纤维肌痛治疗空白
乐瑞卡新适应症在华获批上市 填补纤维肌痛治疗空白 FDA批准拜耳利伐沙班用于冠状动脉疾病或外周动脉疾病患者
FDA批准拜耳利伐沙班用于冠状动脉疾病或外周动脉疾病患者 门静脉高压相关性肺动脉高压(PoPH)首个随机对照试验显示傲朴舒(马昔腾坦)与安慰剂相比显著改善肺血管阻力
门静脉高压相关性肺动脉高压(PoPH)首个随机对照试验显示傲朴舒(马昔腾坦)与安慰剂相比显著改善肺血管阻力 中国甲状腺癌领域首项多中心真实世界研究结果公布
中国甲状腺癌领域首项多中心真实世界研究结果公布 达格列净被证实安全性良好有效降低心衰住院与心血管死亡风险
达格列净被证实安全性良好有效降低心衰住院与心血管死亡风险 手足口病无药可治困局有望破解,全球首个治疗药苏拉明钠临床启动研讨会召开
手足口病无药可治困局有望破解,全球首个治疗药苏拉明钠临床启动研讨会召开 亚盛医药用于治疗格列卫耐药CML的原创1类新药HQP1351临床I期结果首发 为国内首个第三代BCR-ABL抑制剂2018-09-19
亚盛医药用于治疗格列卫耐药CML的原创1类新药HQP1351临床I期结果首发 为国内首个第三代BCR-ABL抑制剂2018-09-19 拜耳利伐沙班获欧盟批准用于冠状动脉疾病或外周动脉疾病患者
拜耳利伐沙班获欧盟批准用于冠状动脉疾病或外周动脉疾病患者 百时美施贵宝欧狄沃三季度即将登陆中国
百时美施贵宝欧狄沃三季度即将登陆中国 一次检测多个基因 中国首个肿瘤多基因二代测序检测试剂盒获批上市
一次检测多个基因 中国首个肿瘤多基因二代测序检测试剂盒获批上市 中国首个泛基因型HCV单一片剂丙通沙正式上市
中国首个泛基因型HCV单一片剂丙通沙正式上市 赛诺菲旗下多发性硬化口服治疗药物奥巴捷在华获批
赛诺菲旗下多发性硬化口服治疗药物奥巴捷在华获批 西安杨森旗下亿珂 获批适应症扩展
西安杨森旗下亿珂 获批适应症扩展 我省丙肝基因1b型患者超40%,专家建议先检测再治疗
我省丙肝基因1b型患者超40%,专家建议先检测再治疗 国内首个ITP口服TPO-RA药物上市 开创迅速升板治疗新时代
国内首个ITP口服TPO-RA药物上市 开创迅速升板治疗新时代 默克联合西安杨森推降糖新药:把糖“尿”出去!
默克联合西安杨森推降糖新药:把糖“尿”出去! 创新药物闪耀CNPDW 新药新疗法推动治疗目标更新
创新药物闪耀CNPDW 新药新疗法推动治疗目标更新 全球首个手足口病治疗药物获美国专利授权
全球首个手足口病治疗药物获美国专利授权 眼底黄斑类疾病再出克星 患者获更优选择
眼底黄斑类疾病再出克星 患者获更优选择 III期试验证实,Imfinzi 显著延长非小细胞肺癌患者总生存期
III期试验证实,Imfinzi 显著延长非小细胞肺癌患者总生存期 中国首个一周一次降糖药上市 开启中国糖尿病的周治疗时代
中国首个一周一次降糖药上市 开启中国糖尿病的周治疗时代 善妥达获批用于精神分裂症治疗
善妥达获批用于精神分裂症治疗 18年磨一剑 国产乙肝新药“乐复能”宣布在全球上市
18年磨一剑 国产乙肝新药“乐复能”宣布在全球上市 默沙东慢性丙肝口服抗病毒药物艾尔巴韦格拉瑞韦片在华获批
默沙东慢性丙肝口服抗病毒药物艾尔巴韦格拉瑞韦片在华获批 拜耳公司艾力雅(阿柏西普眼内注射溶液)获得国家药品监督管理局批准用于治疗成人新生血管(湿性)年龄相关性黄斑变性(nAMD)
拜耳公司艾力雅(阿柏西普眼内注射溶液)获得国家药品监督管理局批准用于治疗成人新生血管(湿性)年龄相关性黄斑变性(nAMD) 全面改善抑郁症状 灵北创新型抗抑郁药心达悦中国上市
全面改善抑郁症状 灵北创新型抗抑郁药心达悦中国上市 抗击矮小症 原研进口的生长激素诺泽在中国正式上市
抗击矮小症 原研进口的生长激素诺泽在中国正式上市 替格瑞洛60 mg上市 助力高危心梗后人群全程保护
替格瑞洛60 mg上市 助力高危心梗后人群全程保护 ODYSSEYOUTCOMES研究达到主要终点
ODYSSEYOUTCOMES研究达到主要终点 被证能降低心血管死亡风险38%的降糖药——欧唐静在中国上市
被证能降低心血管死亡风险38%的降糖药——欧唐静在中国上市 灵北创新型抗抑郁药心达悦(氢溴酸伏硫西汀片)获CFDA批准
灵北创新型抗抑郁药心达悦(氢溴酸伏硫西汀片)获CFDA批准 艾尔建突破性眼科新药傲迪适(Ozurdex)获上市批准
艾尔建突破性眼科新药傲迪适(Ozurdex)获上市批准 美国FDA授予Lynparza治疗转移性乳腺癌优先审评资格
美国FDA授予Lynparza治疗转移性乳腺癌优先审评资格 首个治疗肺栓塞的新型口服抗凝药拜瑞妥在华上市
首个治疗肺栓塞的新型口服抗凝药拜瑞妥在华上市 CFDA批准三生制药单克隆抗体新药临床试验
CFDA批准三生制药单克隆抗体新药临床试验 多款丙肝新药在华上市 四大维度助选治疗方案
多款丙肝新药在华上市 四大维度助选治疗方案 美国FDA授予泰瑞沙用于一线治疗EGFR突变阳性非小细胞肺癌患者的突破性疗法称号
美国FDA授予泰瑞沙用于一线治疗EGFR突变阳性非小细胞肺癌患者的突破性疗法称号 首个超长效基础胰岛素类似物诺和达 (德谷胰岛素注射液)在中国获得上市批准
首个超长效基础胰岛素类似物诺和达 (德谷胰岛素注射液)在中国获得上市批准 阿斯利康在2017欧洲肿瘤内科学会年会公布PACIFIC 试验结果:IMFINZI可显著延长无法手术切除的局部晚期肺癌患者的无疾病进展生存期
阿斯利康在2017欧洲肿瘤内科学会年会公布PACIFIC 试验结果:IMFINZI可显著延长无法手术切除的局部晚期肺癌患者的无疾病进展生存期 2017欧洲肿瘤内科学会年会:阿斯利康泰瑞沙有望成为EGFR突变阳性肺癌一线治疗新标准
2017欧洲肿瘤内科学会年会:阿斯利康泰瑞沙有望成为EGFR突变阳性肺癌一线治疗新标准 眼内抗新生血管药物首进医保 患者经济负担降八成
眼内抗新生血管药物首进医保 患者经济负担降八成 首个儿童抗乙肝病毒药在中国获批!
首个儿童抗乙肝病毒药在中国获批! 首个全口服直接抗丙肝病毒治疗方案 —— 百立泽联合速维普正式在中国上市
首个全口服直接抗丙肝病毒治疗方案 —— 百立泽联合速维普正式在中国上市 首个全口服直接抗丙肝病毒治疗方案在中国上市
首个全口服直接抗丙肝病毒治疗方案在中国上市 罗氏VENTANA PD-L1(SP263)检测获得CE认证批准将其适应症扩展至辅助肺癌患者KEYTRUDA(pembrolizumab)免疫疗法的治疗决策
罗氏VENTANA PD-L1(SP263)检测获得CE认证批准将其适应症扩展至辅助肺癌患者KEYTRUDA(pembrolizumab)免疫疗法的治疗决策 从临床研究进展深度剖析“阿帕替尼”的真实一面2017-05-17
从临床研究进展深度剖析“阿帕替尼”的真实一面2017-05-17 第三代肺癌靶向药助患者突破耐药瓶颈
第三代肺癌靶向药助患者突破耐药瓶颈 斯丹赛与Vericel战略合作引进3款FDA获批细胞治疗产品 数千万患者有望受益2017-05-11
斯丹赛与Vericel战略合作引进3款FDA获批细胞治疗产品 数千万患者有望受益2017-05-11 SGLT2抑制剂安达唐上市中国 降糖还有心血管获益
SGLT2抑制剂安达唐上市中国 降糖还有心血管获益 拜万戈(瑞戈非尼)在华上市 创新结直肠癌靶向治疗选择2017-05-08
拜万戈(瑞戈非尼)在华上市 创新结直肠癌靶向治疗选择2017-05-08 可用于婴幼儿的13价肺炎球菌多糖结合疫苗上市 多地迎来第一针
可用于婴幼儿的13价肺炎球菌多糖结合疫苗上市 多地迎来第一针 奥拉帕尼III期研究证实作为BRCA突变卵巢癌的维持治疗可延长疾病无进展生存时间
奥拉帕尼III期研究证实作为BRCA突变卵巢癌的维持治疗可延长疾病无进展生存时间 Motif Bio新型抗生素Iclaprim3期临床试验获得里程碑式进展
Motif Bio新型抗生素Iclaprim3期临床试验获得里程碑式进展 依维莫司通过英国重新审查 作为二线药物治疗肾细胞癌
依维莫司通过英国重新审查 作为二线药物治疗肾细胞癌 FDA将加速审批Keytruda联合化疗治疗肺癌的申请
FDA将加速审批Keytruda联合化疗治疗肺癌的申请 默克与Vertex合作开发肿瘤疗法
默克与Vertex合作开发肿瘤疗法 抗疟疾神药氯喹或能有效治疗癌症
抗疟疾神药氯喹或能有效治疗癌症 Lucentis获FDA批准治疗近视性脉络膜新生血管
Lucentis获FDA批准治疗近视性脉络膜新生血管 诺华Cosentyx获英国NICE批准治疗银屑病关节炎
诺华Cosentyx获英国NICE批准治疗银屑病关节炎 新型药物或能有效阻断90%的黑色素瘤转移
新型药物或能有效阻断90%的黑色素瘤转移 武田携手PvP开发乳糜泻治疗药物KumaMax
武田携手PvP开发乳糜泻治疗药物KumaMax Halozyme胰腺癌疗法临床研究收获积极研究成果
Halozyme胰腺癌疗法临床研究收获积极研究成果 全球首个脊髓性肌萎缩症治疗药Spinraza获FDA批准
全球首个脊髓性肌萎缩症治疗药Spinraza获FDA批准 强生向FDA提交重磅抗炎药Stelara补充生物制品许可
强生向FDA提交重磅抗炎药Stelara补充生物制品许可 Vimpat获欧盟批准单药治疗部分发作性癫痫
Vimpat获欧盟批准单药治疗部分发作性癫痫 CHMP认可恩格列净可降低心血管疾病死亡风险
CHMP认可恩格列净可降低心血管疾病死亡风险 礼来口服抗炎药baricitinib获欧盟CHMP支持批准
礼来口服抗炎药baricitinib获欧盟CHMP支持批准 新型癌症靶向化疗技术或有望引入人类临床试验中
新型癌症靶向化疗技术或有望引入人类临床试验中 吉利德向FDA提交SOF/VEL/VOX上市申请
吉利德向FDA提交SOF/VEL/VOX上市申请 GSK向欧盟提交慢阻肺三联疗法FF/UMEC/VI上市申请
GSK向欧盟提交慢阻肺三联疗法FF/UMEC/VI上市申请 GSK向EMA提交带状疱疹疫苗Shingrix生物制品上市许可申请
GSK向EMA提交带状疱疹疫苗Shingrix生物制品上市许可申请 斯耐瑞获CFDA临床批件 治疗耐多药肺结核
斯耐瑞获CFDA临床批件 治疗耐多药肺结核 研究显示:塞来昔布与布洛芬和萘普生具有相似的心血管风险
研究显示:塞来昔布与布洛芬和萘普生具有相似的心血管风险 Genmab/强生Darzalex三联疗法获FDA批准
Genmab/强生Darzalex三联疗法获FDA批准 艾伯维修美乐获CHMP支持批准用于治疗青少年化脓性汗腺炎
艾伯维修美乐获CHMP支持批准用于治疗青少年化脓性汗腺炎 突破性药物不突破?FDA突破性药物认证引争议
突破性药物不突破?FDA突破性药物认证引争议 特朗普操刀改革FDA 新药审批继续提速
特朗普操刀改革FDA 新药审批继续提速 武田Adcetris重新定义CD30阳性淋巴瘤一线治疗
武田Adcetris重新定义CD30阳性淋巴瘤一线治疗 BioInvent多发性骨髓瘤免疫疗法药Ⅱ期临床试验被暂停
BioInvent多发性骨髓瘤免疫疗法药Ⅱ期临床试验被暂停 雅培生命旗下veliparib获美国FDA孤儿药资格认定
雅培生命旗下veliparib获美国FDA孤儿药资格认定 拜耳提交靶向抗癌药Stivarga上市申请
拜耳提交靶向抗癌药Stivarga上市申请 安进Enbrel获美国FDA批准治疗儿科斑块型银屑病
安进Enbrel获美国FDA批准治疗儿科斑块型银屑病 癌症治疗方法蕴含阿尔茨海默病治疗新希望
癌症治疗方法蕴含阿尔茨海默病治疗新希望 舒尼替尼可延长癌症患者术后的无病生存期
舒尼替尼可延长癌症患者术后的无病生存期 Opdivo治疗转移性尿路上皮癌(mUC)再获新数据
Opdivo治疗转移性尿路上皮癌(mUC)再获新数据 吉利德HIV药物Truvada获英国NICE支持用于PrEP
吉利德HIV药物Truvada获英国NICE支持用于PrEP 诺华Cosentyx获英国NICE批准治疗强直性脊柱炎
诺华Cosentyx获英国NICE批准治疗强直性脊柱炎 FDA授予罗氏Actemra/RoActemra第2个突破性药物资格
FDA授予罗氏Actemra/RoActemra第2个突破性药物资格 新型长效宫内节育器Kyleena获美欧2大市场批准
新型长效宫内节育器Kyleena获美欧2大市场批准 Eylea获NICE批准一线治疗视网膜分枝静脉阻塞(BRVO)继发黄斑水肿
Eylea获NICE批准一线治疗视网膜分枝静脉阻塞(BRVO)继发黄斑水肿 NICE拒绝罗氏Esbriet用于早期肺特发性纤维化
NICE拒绝罗氏Esbriet用于早期肺特发性纤维化 罗氏新药Ocrevus显著提高多发性硬化症疾病控制
罗氏新药Ocrevus显著提高多发性硬化症疾病控制 安进新一代肾脏病药物Parsabiv获欧盟CHMP支持批准
安进新一代肾脏病药物Parsabiv获欧盟CHMP支持批准 Oncolys BioPharma将开展黑色素瘤溶瘤疗法OBP-301临床试验
Oncolys BioPharma将开展黑色素瘤溶瘤疗法OBP-301临床试验 罗氏牵手BioLineRx开发免疫肿瘤学组合疗法
罗氏牵手BioLineRx开发免疫肿瘤学组合疗法 Opdivo收获日本市场肾癌适应症
Opdivo收获日本市场肾癌适应症 AZ哮喘药物benralizumab两项III期临床取得成功
AZ哮喘药物benralizumab两项III期临床取得成功 武田启动登革热疫苗TAK-003全球性III期临床研究
武田启动登革热疫苗TAK-003全球性III期临床研究 Retrophin罕见肾病药sparsentanII期临床效果显著
Retrophin罕见肾病药sparsentanII期临床效果显著 FDA授予TG Therapeutics公司2个药物孤儿药地位
FDA授予TG Therapeutics公司2个药物孤儿药地位 百健阿尔兹海默症新药获FDA快速审批待遇
百健阿尔兹海默症新药获FDA快速审批待遇 FDA加速批准Blincyto治疗儿科Ph-急性淋巴细胞白血病
FDA加速批准Blincyto治疗儿科Ph-急性淋巴细胞白血病 Arzerra获FDA批准治疗复发性慢性淋巴细胞白血病
Arzerra获FDA批准治疗复发性慢性淋巴细胞白血病 FDA受理杰特贝林皮下预防性治疗药物CSL830上市申请
FDA受理杰特贝林皮下预防性治疗药物CSL830上市申请 维生素C或可增加AML标准疗法的疗效
维生素C或可增加AML标准疗法的疗效 拜耳眼科药物Eylea获NICE批准作为一线治疗方案
拜耳眼科药物Eylea获NICE批准作为一线治疗方案 FDA暂缓批准赛诺菲/Zealand糖尿病新药IGlarLixi
FDA暂缓批准赛诺菲/Zealand糖尿病新药IGlarLixi 抑制肺癌患者对药物产生耐受性的新策略
抑制肺癌患者对药物产生耐受性的新策略 新一代高效乳腺癌药物或即将诞生
新一代高效乳腺癌药物或即将诞生 艾伯维venetoclax进入英国早期获药计划(EAMS)
艾伯维venetoclax进入英国早期获药计划(EAMS) 安进新一代肾脏病药物Parsabiv上市申请遭FDA否决
安进新一代肾脏病药物Parsabiv上市申请遭FDA否决 FDA授予口服BACE抑制剂AZD3293快车道地位
FDA授予口服BACE抑制剂AZD3293快车道地位 默沙东丙肝药物Zepatier获欧盟委员会批准
默沙东丙肝药物Zepatier获欧盟委员会批准 施贵宝Opdivo折戟NSCLC一线疗法!
施贵宝Opdivo折戟NSCLC一线疗法! 鼻子里发现的新型抗生素可有效杀伤“超级细菌”
鼻子里发现的新型抗生素可有效杀伤“超级细菌” PTC杜氏肌营养不良药物Translarna获NICE支持批准
PTC杜氏肌营养不良药物Translarna获NICE支持批准 辉瑞/Spark血友病基因疗法获FDA授予突破性疗法认定
辉瑞/Spark血友病基因疗法获FDA授予突破性疗法认定 阿斯利康DPP4/SGLT2抑制剂组合疗法Qtern获欧盟批准
阿斯利康DPP4/SGLT2抑制剂组合疗法Qtern获欧盟批准 TNF抑制剂Cimzia获英国NICE批准用于类风湿性关节炎
TNF抑制剂Cimzia获英国NICE批准用于类风湿性关节炎 阿斯利康叫板FDA 要求终止批准瑞舒伐他汀仿制药
阿斯利康叫板FDA 要求终止批准瑞舒伐他汀仿制药 逆势而为?Patheon将进行6亿2千5百万美元IPO
逆势而为?Patheon将进行6亿2千5百万美元IPO 日本Ono3亿获得Celyad新型肿瘤免疫疗法地区特许权
日本Ono3亿获得Celyad新型肿瘤免疫疗法地区特许权 重磅!最新研究再次肯定HIV疫苗RV144的效用
重磅!最新研究再次肯定HIV疫苗RV144的效用 Shire将再次提交小儿多动症药物SHP 465美国上市申请
Shire将再次提交小儿多动症药物SHP 465美国上市申请 百时美收购Cormorant 加强肿瘤微环境及免疫组合资产
百时美收购Cormorant 加强肿瘤微环境及免疫组合资产 赛诺菲与美国陆军研究所(WRAIR)合作开发寨卡疫苗
赛诺菲与美国陆军研究所(WRAIR)合作开发寨卡疫苗 新一代药物坎格列净或可有效治疗2型糖尿病
新一代药物坎格列净或可有效治疗2型糖尿病 瑞戈非尼显著改善无法切除的肝癌患者的总生存期
瑞戈非尼显著改善无法切除的肝癌患者的总生存期 强生获得OSE公司CD28拮抗剂药物授权
强生获得OSE公司CD28拮抗剂药物授权 赛诺菲新一代降脂药Praluent获日本批准
赛诺菲新一代降脂药Praluent获日本批准 诺华药物midostaurin整体缓解率达60%
诺华药物midostaurin整体缓解率达60% 默沙东与Premier达成战略合作预防骨质疏松症患者骨折
默沙东与Premier达成战略合作预防骨质疏松症患者骨折 卫材在墨西哥推出新型口服抗癌药Lenvima
卫材在墨西哥推出新型口服抗癌药Lenvima Imbruvica治疗慢性移植物抗宿主病的突破性药物资格
Imbruvica治疗慢性移植物抗宿主病的突破性药物资格 液态阿司匹林杀死脑癌细胞的效率比化疗提高10倍!
液态阿司匹林杀死脑癌细胞的效率比化疗提高10倍! 新疗法仅需单剂注射和一束光就可杀死高达95%的癌细胞
新疗法仅需单剂注射和一束光就可杀死高达95%的癌细胞 FDA批准吉利德全球首个泛基因型丙肝鸡尾酒Epclusa
FDA批准吉利德全球首个泛基因型丙肝鸡尾酒Epclusa Keytruda治疗晚期非小细胞肺癌新适应症获CHMP支持批准
Keytruda治疗晚期非小细胞肺癌新适应症获CHMP支持批准 Opdivo斩获FDA第6个突破性药物资格
Opdivo斩获FDA第6个突破性药物资格 FDA授予Jakavi治疗GVHD的突破性药物资格
FDA授予Jakavi治疗GVHD的突破性药物资格 CFDA批准台湾太景新抗生素产品Taigexyn
CFDA批准台湾太景新抗生素产品Taigexyn 梯瓦Vantrela ER获FDA专家委员会支持批准
梯瓦Vantrela ER获FDA专家委员会支持批准 辉瑞止痛药ALO-02获FDA专家委员会支持批准
辉瑞止痛药ALO-02获FDA专家委员会支持批准 抗梭菌感染单抗Zinplava获FDA专家委员会支持批准
抗梭菌感染单抗Zinplava获FDA专家委员会支持批准 欧盟批准安维汀联合特罗凯一线治疗EGFR激活突变型非小细胞肺癌
欧盟批准安维汀联合特罗凯一线治疗EGFR激活突变型非小细胞肺癌 Atezolizumab重新训练免疫系统高效地抵抗晚期膀胱癌
Atezolizumab重新训练免疫系统高效地抵抗晚期膀胱癌 FDA授予强生埃博拉病毒检测试剂盒紧急使用授权
FDA授予强生埃博拉病毒检测试剂盒紧急使用授权 FDA批准首个植入性阿片成瘾药物Probuphine
FDA批准首个植入性阿片成瘾药物Probuphine  强生抗炎药SIMPONI获欧盟CHMP支持批准
强生抗炎药SIMPONI获欧盟CHMP支持批准 risankizumab克罗恩病II期临床诱导显著缓解
risankizumab克罗恩病II期临床诱导显著缓解 FDA批准强生降糖药INVOKAMET用于2型糖尿病一线治疗
FDA批准强生降糖药INVOKAMET用于2型糖尿病一线治疗 卫材在日本推出新一代抗癫痫药物Fycompa
卫材在日本推出新一代抗癫痫药物Fycompa 帕金森药物进展!新药 Xadago正式登陆英国
帕金森药物进展!新药 Xadago正式登陆英国 诺华Zykadia获英国NICE推荐治疗ALK阳性肺癌
诺华Zykadia获英国NICE推荐治疗ALK阳性肺癌 诺和诺德糖尿病新药IDegLira如何收获FDA信任?
诺和诺德糖尿病新药IDegLira如何收获FDA信任? 辉瑞/诺华夹击 礼来CDK4/6新药如何脱颖而出?
辉瑞/诺华夹击 礼来CDK4/6新药如何脱颖而出? 阿斯利康哮喘新药benralizumab收获巨大成功
阿斯利康哮喘新药benralizumab收获巨大成功 Ultibro Breezhaler临床试验结果优于Seretide
Ultibro Breezhaler临床试验结果优于Seretide 喜大普奔!百时美两款肿瘤免疫疗法欧洲获批!
喜大普奔!百时美两款肿瘤免疫疗法欧洲获批! selumetinib甲状腺癌适应症获授予孤儿药资格认定
selumetinib甲状腺癌适应症获授予孤儿药资格认定 GSK红斑狼疮药物Benlysta获英国NICE批准
GSK红斑狼疮药物Benlysta获英国NICE批准
