礼来制药2020年5月9日宣布,FDA批准了Retevmo(selpercatinib 40毫克、80毫克胶囊)专门用于治疗转染重排基因(RET)融合阳性的转移性非小细胞肺癌(NSCLC)的成年患者,和需要系统性治疗的携带RET突变的晚期或转移性甲状腺髓样癌成人和12岁及以上的儿童患者,以及需要系统性治疗和放射性碘治疗(如适用)难治的RET融合阳性的晚期或转移性甲状腺癌成人和12岁及以上的儿童患者。
Retevmo是一种口服选择性RET激酶抑制剂。Retevmo既作用于肿瘤细胞,也可影响正常细胞,这可能导致药物副反应的发生。
美国纪念斯隆凯特琳癌症中心早期药物研发代理负责人、LIBRETTO-001研究牵头研究者Alexander Drilon博士指出:“在临床试验中,我们观察到大多数转移性肺癌患者,包括难治性脑转移患者,在使用selpercatinib治疗时均出现具有临床意义的缓解。Selpercatinib的获批是NSCLC治疗的重要里程碑,它使存在RET基因变异驱动的癌症可以像存在激活的EGFR和ALK改变的癌症一样,在全病程的治疗中具有靶向性。我很欣慰这些RET驱动型癌症治疗有了新的选择。”
单臂多中心I/II期LIBRETTO-001试验对Retevmo进行了评估,这是针对RET驱动型癌症患者规模最大的一项临床试验(N=702)。该临床试验既纳入了初治患者,也纳入了经治的各种晚期实体肿瘤患者,包括RET融合阳性的NSCLC、RET突变的MTC、RET融合阳性的甲状腺癌以及其它RET改变的实体肿瘤。主要疗效结果为ORR和DoR,由独立评估委员会评估。预设的次要研究终点包括中枢神经系统(CNS)ORR和CNS DoR。
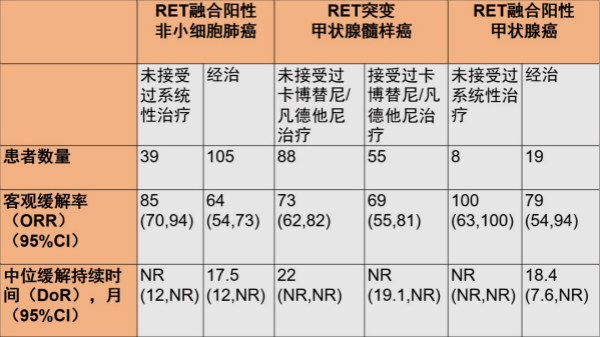
NR=未达到
甲状腺癌包括:乳头状癌、Hurthle细胞、未分化、低分化
在高达50%的RET融合阳性的非小细胞肺癌患者中存在脑转移的情况。在经治的可检测到脑转移的NSCLC患者中,11名患者中有10名观察到颅内病灶的缓解(CNS ORR),所有10名患者的CNS DoR均≥6个月。
Retevmo的说明书中的警告和注意事项包括:肝毒性(肝功能异常的证据)、高血压、QT间隔延长、出血事件、过敏反应、伤口愈合不良的风险和胚胎胎儿毒性。
在LIBRETTO-001试验中,由于不良反应(AR)导致的停药率为5%。最常见的不良反应(≥25%),含实验室异常,包括口干、腹泻、高血压、天冬氨酸转氨酶(AST)升高、丙氨酸转氨酶(ALT)升高、疲劳和便秘。此外,最常见的严重不良反应(≥2%)是ALT升高、AST升高和肺炎。没有其他的严重不良反应在超过2%的患者中报告。
“大部分的甲状腺髓样癌及相当大比例的其它甲状腺癌的患者都存在RET改变的情况。对于这些癌症患者而言,selpercatinib的获批意味着他们现在有了能够选择性地并强效地抑制RET的治疗方案,”美国马萨诸塞州总医院癌症中心头颈癌医学总监Lori J. Wirth博士表示,“基于该新药的公开数据以及我治疗患者的个人经验,这可能是一个不错的治疗选择。”
礼来肿瘤业务总裁Anne White表示:“Retevmo于2017年5月进入临床试验阶段,现在不到三年就获得批准,这是业界开发多项适应症肿瘤药物的最快时间。”
Retevmo仅适用于发生RET融合的晚期或转移性NSCLC或甲状腺癌患者,或发生RET突变的晚期或转移性甲状腺髓样癌患者。这需要通过生物标志物检测来确定。通过肿瘤组织活检或液体活检的下一代测序(NGS)可以作为确定包括RET在内的基因改变的合适的生物标志物检测。如果无法通过NGS进行检测,则可以使用其它生物标志物检测方法检测RET。
目前尚无FDA已批准的可用于检测RET融合和RET突变的测试方法。在LIBRETTO-001中,本地实验室使用NGS、PCR或FISH前瞻性地测定了血浆或肿瘤组织中RET基因改变。免疫组织化学未被用于这些临床试验。
Retevmo被FDA授予孤儿药资格认定,用于治疗RET融合阳性NSCLC以及治疗RET融合阳性和RET突变的甲状腺癌,包括低分化甲状腺癌、未分化或间变性甲状腺癌、甲状腺髓样癌和局部晚期或转移性滤泡性或乳头状甲状腺癌。两项确证性的III期试验(LIBRETTO-431和LIBRETTO-531)目前正在招募患者。
 39健康网
39健康网 万万没想到,“神药”二甲双胍会在这“小病”遇滑铁卢?2021-11-09
万万没想到,“神药”二甲双胍会在这“小病”遇滑铁卢?2021-11-09 这4类药,儿童不宜服用!记下来千万别中招2021-10-14
这4类药,儿童不宜服用!记下来千万别中招2021-10-14 国庆小长假想放飞自我?这5个用药规则千万别忘记!2021-09-30
国庆小长假想放飞自我?这5个用药规则千万别忘记!2021-09-30 疾病负担日益加重 新药研发失败率高 AD如何与寿命“赛跑”?2021-09-24
疾病负担日益加重 新药研发失败率高 AD如何与寿命“赛跑”?2021-09-24 长期服用阿片类药物患者换为丁丙诺啡,风险有多大?2021-09-10
长期服用阿片类药物患者换为丁丙诺啡,风险有多大?2021-09-10 Circulation:降脂“神药”他汀居然还能改善子痫发作!2021-09-06
Circulation:降脂“神药”他汀居然还能改善子痫发作!2021-09-06 Lancet:近2万人数据提示,不同血压、血脂、血糖,多合一药物都更好!2021-09-02
Lancet:近2万人数据提示,不同血压、血脂、血糖,多合一药物都更好!2021-09-02 再添证据!减肥“神药”索马鲁特每周一次的最佳剂量来了!2021-08-26
再添证据!减肥“神药”索马鲁特每周一次的最佳剂量来了!2021-08-26 促进儿童钙吸收吃什么2024-11-22
促进儿童钙吸收吃什么2024-11-22 单绒双羊的宝宝健康吗2024-11-22
单绒双羊的宝宝健康吗2024-11-22 吃什么补锌儿童2024-11-21
吃什么补锌儿童2024-11-21
 自卑心理评估,测你内心真实的自卑程度心理测试
自卑心理评估,测你内心真实的自卑程度心理测试 测一测自己用药的安全系数心理测试
测一测自己用药的安全系数心理测试





