2016年6月,在第 52 届美国临床肿瘤学会年会(ASCO)上,一项多臂、1b期试验,用于评估两个肿瘤免疫药物nivolumab和ipilimumab在未经化疗的晚期非小细胞肺癌患者中疗效的CheckMate-012最新研究数据获得公布(Abstract #3001)。在这项试验中,nivolumab作为单药,或与包括ipilimumab在内的其他药物联合,予以不同给药剂量和时间方案来进行研究。nivolumab单药组和其他组的数据此前已经公布过。
本次最新的研究成果包括两组nivolumab和ipilimumab联合使用的汇总分析“每两周3 mg/kg的nivolumab+每六周 (Q6W)或每12周(Q12W) (n = 77)1 mg/kg 的 Yervoy”,显示出随着 PD-L1 表达率的上升,联合疗法的应答率增加。在这些联合用药组中,PD-L1的表达≥1%的患者客观缓解率达到57%,PD-L1的表达≥50% 的患者客观缓解率高达92%(n = 12/13),PD-L1 的表达<1%的患者客观缓解率高为15%。Q12W组和Q6W组在总人群中的客观缓解率分别为47%和39%,这包括了无论任何 PD-L1 表达水平的所有患者。
研究中Q12W组、Q6W组和nivolumab单药组的治疗相关的3/4级不良事件发生率分别为37%、33%及19%,治疗相关的3/4级不良事件导致治疗中断率分别为5%、8%和10%。未出现治疗相关死亡。
百时美施贵宝肿瘤全球临床研究负责人Jean Viallet博士评论道:我们发现nivolumab和ipilimumab联合疗法在一线治疗晚期非小细胞肺癌中的结果令人叹服。这些数据给予我们在晚期非小细胞肺癌患者的进一步研究中对识别优化的联合给药方案更多支持。我们将继续推进肿瘤免疫治疗的临床研究,我们的目标是给患者提供改善预后的、有潜力的一线治疗肺癌药物。
CheckMate -012是一项多臂、1b 期试验,用于评估 nivolumab 作为单药,或联合包括 ipilimumab 在内的其他药物,以不同给药剂量和时间治疗未经化疗的晚期非小细胞肺癌患者的安全性和耐受性。研究主要终点为安全性,次要终点为客观缓解率(ORR)和 24 周无进展生存期(PFS)。探索性终点包括总生存期(OS)以及不同PD-L1表达水平下的疗效。这项研究检测患者的 PD-L1 表达水平,在 Q12W 组和 Q6W 组中,分别有 68% 和 71% 的患者对PD-L1有表达。
CheckMate -012研究在ASCO上公布的三种给药方案的疗效和安全性结果如下:
CheckMate -012研究同时评估了不同PD-L1表达水平下的疗效,一个探索性终点,即 Opdivo单药(此前已经公布)以及 nivolumab与ipilimumab联合使用在Q6W、Q12W不同给药方案下的疗效。下表即为 2016 年ASCO年会中公布的不同PD-L1表达水平下的疗效结果。
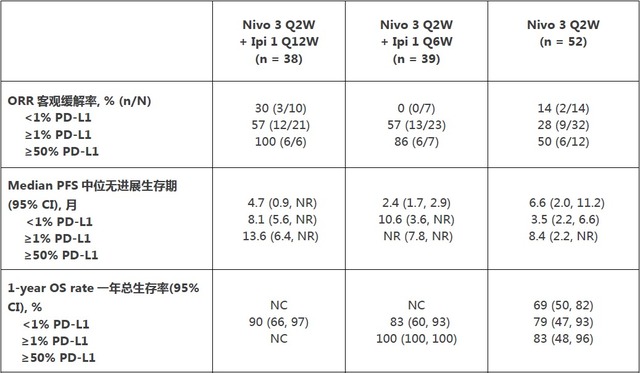
Q12W 组(82%)和 Q6W 组(72%)的总体不良事件发生概率与单药组 (71%) 大致相当。在这项试验中,Q12W 组、Q6W 组和 nivolumab 单药组的 3/4 级不良事件 (AEs) 分别为 37%、33% 和 19%。在 Q12W 组和 Q6W 组中,治疗相关的 3/4 级不良事件导致的治疗中断率分别为 5% 和 8%,与 nivolumab 单药组的治疗中断率十分接近。未出现治疗相关死亡。在优化的给药方案(每两周 3 mg/kg 的 nivolumab + 每六周 1 mg/kg 的 ipilimumab)的患者中,治疗相关的不良事件包括皮肤相关(36%)、胃肠道(23%)、内分泌系统(20%)和肺部(6%),每类 3/4 级治疗相关不良事件≤5%。
PD-L1表达>1%的患者在nivolumab和ipilimumab联合用药组中证实客观缓解率达到57%的,是此前公布的nivolumab单药组应答率的两倍。
联合用药组显示随着PD-L1表达率的逐步提升,疗效增强,PD-L1表达≥50%的患者其应答率可达92%。与之前非小细胞肺癌研究相比,当前nivolumab和ipilimumab联合用药组中观测到的安全性和耐受性得到改善。
 39健康网
39健康网 万万没想到,“神药”二甲双胍会在这“小病”遇滑铁卢?2021-11-09
万万没想到,“神药”二甲双胍会在这“小病”遇滑铁卢?2021-11-09 这4类药,儿童不宜服用!记下来千万别中招2021-10-14
这4类药,儿童不宜服用!记下来千万别中招2021-10-14 国庆小长假想放飞自我?这5个用药规则千万别忘记!2021-09-30
国庆小长假想放飞自我?这5个用药规则千万别忘记!2021-09-30 疾病负担日益加重 新药研发失败率高 AD如何与寿命“赛跑”?2021-09-24
疾病负担日益加重 新药研发失败率高 AD如何与寿命“赛跑”?2021-09-24 长期服用阿片类药物患者换为丁丙诺啡,风险有多大?2021-09-10
长期服用阿片类药物患者换为丁丙诺啡,风险有多大?2021-09-10 Circulation:降脂“神药”他汀居然还能改善子痫发作!2021-09-06
Circulation:降脂“神药”他汀居然还能改善子痫发作!2021-09-06 Lancet:近2万人数据提示,不同血压、血脂、血糖,多合一药物都更好!2021-09-02
Lancet:近2万人数据提示,不同血压、血脂、血糖,多合一药物都更好!2021-09-02 再添证据!减肥“神药”索马鲁特每周一次的最佳剂量来了!2021-08-26
再添证据!减肥“神药”索马鲁特每周一次的最佳剂量来了!2021-08-26 促进儿童钙吸收吃什么2024-11-22
促进儿童钙吸收吃什么2024-11-22 单绒双羊的宝宝健康吗2024-11-22
单绒双羊的宝宝健康吗2024-11-22 吃什么补锌儿童2024-11-21
吃什么补锌儿童2024-11-21
 自卑心理评估,测你内心真实的自卑程度心理测试
自卑心理评估,测你内心真实的自卑程度心理测试 测一测自己用药的安全系数心理测试
测一测自己用药的安全系数心理测试






