世界中医药学会联合会于2011年4月16日自17日,借在云南昆明召开第二届第八次理事会和第七次监事会在之机,举办了“首届中医药全球化与人类健康高层论坛”,邀请了多位在欧盟从事中医药工作的专家,研讨过渡期满后,中医药在欧盟的命运、挑战以及应对策略。
一、 如何理解和认识欧盟传统医药《指令》?
1、欧盟药品管理方式与《指令》出台背景
欧盟不是一个单一国家,它是一个国家联盟。因此,相关的法律法规相当复杂。目前,欧盟没有专门针对中国生产的药品或其它国家生产药品的法律法规。2001年4月4日欧盟发布了2001/20/EC指令,该指令系目前指导欧盟临床试验申请与审批的纲领性文件,要求各成员国应于2004年5月1日前将指令有关要求转化为本国法规并贯彻实施。欧盟EC No. 726/2004规章、2001/83/EC指令、2004/27/EC指令是目前指导欧洲新药上市申请与审批的纲领性文件。欧盟法规将新药上市申请与审批划分为四个主要程序:集中注册程序(centralized procedure),相互认可注册程序(mutual-recognition procedure),分散注册程序(decentralized procedure),单一国家注册程序(national procedure)。欧盟EC No. 726/2004规章是关于集中注册程序要求,2001/83/EC指令、2004/27/EC指令是有关相互认可注册程序、分散注册程序、单一国家注册程序的要求。
如果某一种新药,既不属于集中注册程序范围,也不计划在欧盟两个以上成员国家上市销售,仅打算在欧盟某一成员国上市销售,则可以选择单一国家注册程序,欧盟对该程序没有制定统一的要求,由各成员国根据本国的法律法规自行决定。
值得一提的是2001/83/EC指令第10条款首次提出了文献齐全产品概念,2004/27/EC指令对该概念给与进一步明确。2001/83/EC指令考虑到传统医药的特殊性,提出文献齐全产品可简化注册申报资料的管理思路,但在实际操作上,相当多的传统药品,虽然应用历史悠久,但还是不能符合文献齐全产品的要求,不能获得上市注册许可。为了维持这些产品的上市销售,欧盟各成员国制订了不同的程序和规章,但这些程序和规章内容差别很大,阻碍了传统药品在欧盟内部自由流通,也造成了传统药品生产企业的不公平竞争。为了解决上述问题,欧盟决定制定单独的传统药品注册法规。2004年《欧盟传统草药指令》(2004/24/EC)就是在这样的背景下出台的。
欧盟药品监督管理法律法规是随着欧盟的发展而变化发展的。目前,欧盟的药品监督管理法规主要有四种类型:规章、指令、决定和建议。其主要区别是,规章必须无条件地全部直接予以执行;对于指令,相关成员国应进一步细化成员国的相应法规,已达到指令所要求的目标,但具体方法和措施,相关成员国可根据本国实际情况灵活制定;对于决定,相关成员国或法人或自然人应该全部符合其要求;对于建议,仅表达欧盟对于某一问题的建议,供各方面参考。
 39健康网
39健康网 全球首例!试管婴儿技术成功阻断环状染色体,他们终于生下健康宝宝2024-03-20
全球首例!试管婴儿技术成功阻断环状染色体,他们终于生下健康宝宝2024-03-20 周宏伟:用检验医学打造健康新标靶2023-08-24
周宏伟:用检验医学打造健康新标靶2023-08-24 一胖毁所有?不,被你嫌弃多年的脂肪,其实好处不少2023-01-30
一胖毁所有?不,被你嫌弃多年的脂肪,其实好处不少2023-01-30 钟南山张文宏最新研判 :疫情高峰可能在一个月内杀到2022-12-15
钟南山张文宏最新研判 :疫情高峰可能在一个月内杀到2022-12-15 市场监管总局发文:核查哄抬连花清瘟药品价格,已提取多平台数据2022-12-09
市场监管总局发文:核查哄抬连花清瘟药品价格,已提取多平台数据2022-12-09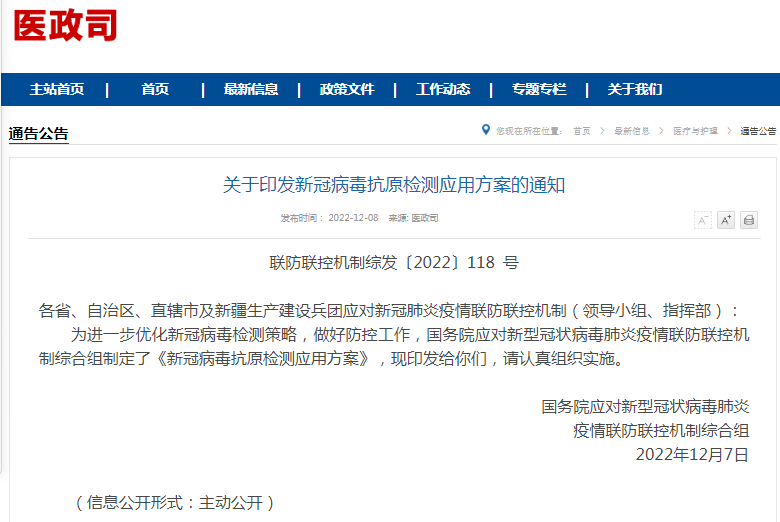 自测阳性向谁报告?老年人群如何检测?国家权威发文2022-12-09
自测阳性向谁报告?老年人群如何检测?国家权威发文2022-12-09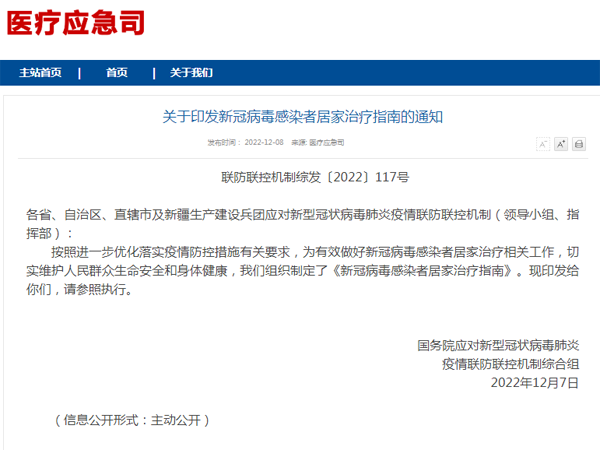 附常用药参考表!国家发布新冠病毒感染者居家治疗指南2022-12-08
附常用药参考表!国家发布新冠病毒感染者居家治疗指南2022-12-08 中国万人研究:8大负面情绪堪称“催老剂”,比抽烟还伤身2022-11-04
中国万人研究:8大负面情绪堪称“催老剂”,比抽烟还伤身2022-11-04 自卑心理评估,测你内心真实的自卑程度心理测试
自卑心理评估,测你内心真实的自卑程度心理测试 你是什么级别的剁手党?心理测试
你是什么级别的剁手党?心理测试 皮肤容易过敏是特禀体质吗?心理测试
皮肤容易过敏是特禀体质吗?心理测试




