2、如何认识和理解《欧盟传统草药指令》(2004/24/EC)
《欧盟传统草药指令》(2004/24/EC)是对2001/83/EC指令的修订和补充。2004/24/EC指令定义了传统草药产品、草药产品、药材和药材原料。
《指令》(2004/24/EC)是欧洲首次对传统草药制订的法规。但《指令》要求对符合下列条件的传统草药才可依据《指令》实施简易注册程序,即登记注册上市。
1、 非处方药。
2、 口服、外用或吸入制剂。注射剂不可以登记上市。
3、 传统使用年限要求:产品必须具有30年以上的使用年限,包括至少15年在欧盟国家使用的年限。
4、 产品原料符合要求。《指令》要求只有源于植物药的产品才能登记上市。产品中可以加入维生素或矿物质,但维生素或矿物质在其中只起辅助作用。动物药不能按此《指令》登记上市。
中药按药品在欧盟注册上市,目前主要有两种途径:注册上市和登记上市。注册上市分两种情形,一是从未在欧盟上市的中药,或虽然在欧盟已上市销售过,但申请新适应证的中药。对于这种情况,欧盟需要提供全新的临床研究数据和临床试验数据,欧盟相关药监机构要对安全性、有效性及质量可控性进行严格评审;另一个情形是科学文献齐全的中药品种,欧盟同意申请人提供安全性、有效性方面的科学文献,不必重新进行临床前研究和临床试验。登记上市,也称简易注册程序,就是允许符合条件的传统草药简化申报资料要求进行登记上市。对于登记上市的产品,如果具有欧盟草药专论或欧盟原料名单,则可豁免传统使用证据和专家报告、文献资料或新研究资料的要求。
从理论上讲,中药在欧盟药品市场可以采取多种上市途径:既可以作为新药上市,也可以作为文献齐全产品上市,还可以作为传统草药上市。但实际上,中药按前两种注册上市途径申请上市难度很大,按新药上市则必须重新开展临床前研究及临床试验,花费大量人力、物力和财力;按文献齐全产品上市,则目前很少有中药产品的科学研究文献资料符合欧盟药品注册条件和要求。因此,对于目前中药产品来说,最切实可行的方法是按传统草药登记上市途径申请上市。
尽管欧盟颁发了《指令》(2004/24/EC),并非要求所有中医药产品今后按药品进行管理。许多中药产品还可以按食品、食品补充剂或者化妆品在欧盟合法销售,如中药饮片及单味颗粒剂在不注明主治功能的情况下,依然可以在欧盟一些国家销售。因此,《指令》(2004/24/EC)主要适用于中国的不含动物、矿物成份的中成药登记上市。
根据欧盟《指令》(2001/83/EC)对于药品的定义,药品是指任何声称具有治疗或预防人体疾病功效的物质,是任何通过药理、免疫、代谢作用,或通过医学诊断手段,可恢复、纠正或调整人体生理功能的物质。只有符合上述条件之一的产品,欧盟才将其按药品进行管理。
 39健康网
39健康网 全球首例!试管婴儿技术成功阻断环状染色体,他们终于生下健康宝宝2024-03-20
全球首例!试管婴儿技术成功阻断环状染色体,他们终于生下健康宝宝2024-03-20 周宏伟:用检验医学打造健康新标靶2023-08-24
周宏伟:用检验医学打造健康新标靶2023-08-24 一胖毁所有?不,被你嫌弃多年的脂肪,其实好处不少2023-01-30
一胖毁所有?不,被你嫌弃多年的脂肪,其实好处不少2023-01-30 钟南山张文宏最新研判 :疫情高峰可能在一个月内杀到2022-12-15
钟南山张文宏最新研判 :疫情高峰可能在一个月内杀到2022-12-15 市场监管总局发文:核查哄抬连花清瘟药品价格,已提取多平台数据2022-12-09
市场监管总局发文:核查哄抬连花清瘟药品价格,已提取多平台数据2022-12-09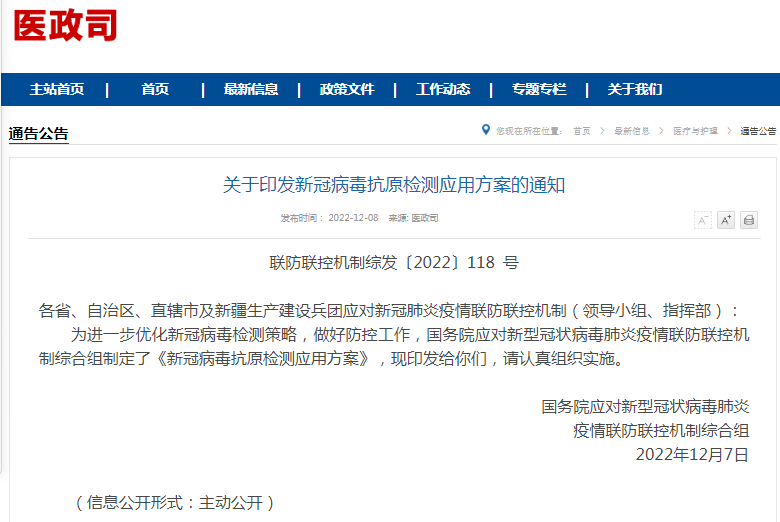 自测阳性向谁报告?老年人群如何检测?国家权威发文2022-12-09
自测阳性向谁报告?老年人群如何检测?国家权威发文2022-12-09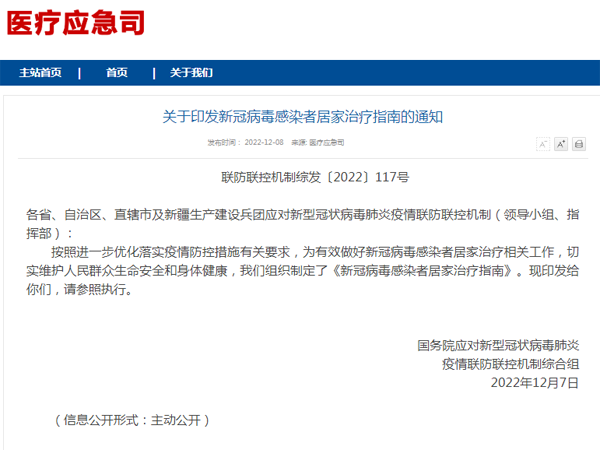 附常用药参考表!国家发布新冠病毒感染者居家治疗指南2022-12-08
附常用药参考表!国家发布新冠病毒感染者居家治疗指南2022-12-08 中国万人研究:8大负面情绪堪称“催老剂”,比抽烟还伤身2022-11-04
中国万人研究:8大负面情绪堪称“催老剂”,比抽烟还伤身2022-11-04 自卑心理评估,测你内心真实的自卑程度心理测试
自卑心理评估,测你内心真实的自卑程度心理测试 你是什么级别的剁手党?心理测试
你是什么级别的剁手党?心理测试 皮肤容易过敏是特禀体质吗?心理测试
皮肤容易过敏是特禀体质吗?心理测试






