强生旗下杨森制药公司近日宣布,欧洲药品管理局(EMA)人用医药产品委员会(CHMP)已发布一份积极审查意见,建议批准其埃博拉疫苗方案(2针免疫方案),用于预防由扎伊尔埃博拉病毒株(Zaire ebolavirus)引起的埃博拉病毒病(EVD)。现在,CHMP的审查意见将递交至欧盟委员会(EC)审查,后者预计将在2个月内做出最终审查决定。
强生向EMA平行提交了2份营销授权申请(MAA),支持2针免疫方案中的每种疫苗(Ad26.ZEBOV,MVA-BN-Filo)。去年9月,CHMP已授予这些MAA加速评估资格。
该疫苗方案为:(1)将Ad26.ZEBOV作为第一针免疫疫苗,该疫苗基于杨森的AdVac技术开发;(2)大约8周后,将MVA-BN-Filo作为第二针免疫疫苗,该疫苗基于Bavarian Nordic公司的MVA-BN技术。2份MAA得到了来自I期、II期和III期临床研究的数据支持,这些临床研究评估了这种疫苗方案在成人和儿童中的安全性和免疫原性,同时还包括了临床前研究和免疫桥接分析数据。这些研究表明,这种疫苗方案具有良好的耐受性,针对扎伊尔埃博拉病毒株诱导产生了强大的、持久的免疫应答。
杨森的埃博拉疫苗方案专门用于支持在有埃博拉爆发风险的国家和地区及其他风险群体(如医疗工作者、生物安全4级实验室工作人员、国家部署的军队、高风险国家的机场工作人员和游客等)提供预防性疫苗接种。目前,杨森正在与世界卫生组织(WHO)合作进行疫苗资格预审,以扩大其埃博拉疫苗方案在需求最高的非洲国家的准入,并使其能够在非洲国家注册。
欧盟委员会(EC)的批准,将有助于加快这一进程。此外,杨森也正在与美国FDA进行讨论,以确定根据FDA的动物(效应)法规许可途径提交上述埃博拉疫苗方案所需的数据。

最近一次埃博拉疫情于2018年在刚果民主共和国(DRC)爆发,是世界上有记录以来第二严重的疫情。它已造成3000多例病例和2000多人死亡,死亡率为65%。
2019年5月,世界卫生组织(WHO)免疫问题战略专家咨询小组(SAGE)建议,使用杨森的埃博拉疫苗方案,作为遏制DRC疫情努力的一部分。在DCR和卢旺达,有超过5万人接种了疫苗。迄今为止,约有6万人在临床研究和疫苗接种倡议中接种了杨森的这种预防性埃博拉疫苗方案。
强生执行委员会副主席兼首席科学官Paul Stoffels医学博士表示:“在DRC的这次疫情中,首次大规模部署了通过综合公共卫生应对措施协调的疫苗,其中包括杨森新型2针疫苗方案。我们对CHMP的积极意见感到高兴,因为它使我们更接近实现强生的最终愿景,即:在埃博拉疫情爆发之前,进一步预防疫情的爆发,并帮助到风险最高的社区。”
杨森制药全球治疗领域负责人Johan Van Hoof医学博士表示:“CHMP的积极意见证实了杨森疫苗技术的潜力,我们希望将其应用于一系列现有和正在出现的流行病威胁,包括COVID-19流行病。如果我们的埃博拉研究疫苗方案得到欧盟委员会的批准,这将是杨森的第一个疫苗批准,也是我们在帮助保护面临埃博拉病毒疾病风险的群体的努力中向前迈出的重要一步。如果没有我们在世界各地的多个合作伙伴的专门知识和奉献精神,我们加速开发和提供埃博拉疫苗的进程是不可能实现的,我们对此深表感谢。”
埃博拉病毒(Ebola)是导致埃博拉出血热(EHF)的元凶,该病是一种急性病毒性出血性传染病,症状包括:发烧、头痛、关节和肌肉疼痛、乏力、腹泻、呕吐、胃痛、食欲不振及异常出血。这些症状可在病毒感染后2-21天内出现,但最常见于8-10天。埃博拉病毒不是一种经水传播(water-borne)或食物传播的疾病,也不通过空气传播,该病通过直接接触受感染者体液或已被病毒污染的器具(如针头)传播。
2019年11月,默沙东的埃博拉疫苗Ervebo(V920,rVSV∆G-ZEBOV-GP,减毒活疫苗)获得欧盟批准,成为全球第一个埃博拉疫苗,该疫苗用于18岁及以上人群的主动免疫,以预防由扎伊尔埃博拉病毒(Ebola Zaire)引起的埃博拉病毒病(EVD)。2019年12月,Ervebo也获得了美国FDA批准。2020年2月,Ervebo获得了首批4个非洲国家(刚果民主共和国、布隆迪、加纳和赞比亚)批准,未来还将获得更多非洲国家的批准。
Ervebo(V920)采用了一种有缺陷的、能够感染家畜的水泡性口炎病毒,将病毒的一种基因用埃博拉病毒的基因替换。V920最初是由加拿大公共卫生署(PHAC)开发,之后在2010年授权给了NewLink Genetics公司。2014年底,当非洲西部埃博拉疫情达到高峰时,默沙东从NewLink公司签署了一项全球独家授权协议,获得了这款埃博拉疫苗。之后,默沙东一直与一些外部合作者密切合作,在美国政府的部分资助下,开展了一项广泛的临床开发项目,对这款疫苗进行开发。(生物谷Bioon.com)
原文出处:Johnson & Johnson Receives Positive CHMP Opinion for Janssen’s Investigational Preventive Ebola Vaccine Regimen


 全球首届胸壁外科大会在广州召开,“Wang手术”获国际认可2025-07-20
全球首届胸壁外科大会在广州召开,“Wang手术”获国际认可2025-07-20 麻醉医生终于有超级AI助手了!我国首个围手术期麻醉管理大模型发布2025-07-11
麻醉医生终于有超级AI助手了!我国首个围手术期麻醉管理大模型发布2025-07-11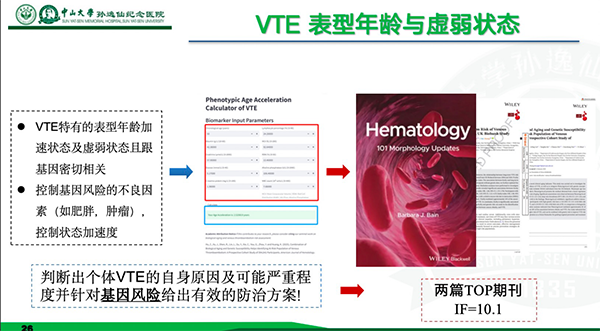 广东医生团队成功研发静脉血栓专科AI智能体,预测精度较传统方法提升40%2025-07-09
广东医生团队成功研发静脉血栓专科AI智能体,预测精度较传统方法提升40%2025-07-09 南方医院交叉医学期刊首获影响因子13.6,跃居国际前列2025-07-06
南方医院交叉医学期刊首获影响因子13.6,跃居国际前列2025-07-06 男子摔伤颈椎导致瘫痪半年,脑机接口技术让他重新走了起来2025-06-12
男子摔伤颈椎导致瘫痪半年,脑机接口技术让他重新走了起来2025-06-12 株洲哪家医院治关节炎专业2025-07-30
株洲哪家医院治关节炎专业2025-07-30 菏泽治近视医院推荐2025-07-30
菏泽治近视医院推荐2025-07-30 肇庆哪家医院治脑卒中比较专业2025-07-30
肇庆哪家医院治脑卒中比较专业2025-07-30 沈阳治疗扁桃体炎医生推荐2025-07-30
沈阳治疗扁桃体炎医生推荐2025-07-30 成都治椎间盘突出医院哪家好2025-07-30
成都治椎间盘突出医院哪家好2025-07-30
