构建新分型,再获新突破!徐瑞华教授团队研究成果助力食管癌免疫治疗精准化
4月13日,肿瘤学国际顶尖期刊Cancer Cell在线发表了中山大学肿瘤防治中心徐瑞华教授团队在晚期食管鳞癌免疫治疗方面最新的前瞻性转化研究成果。在这项研究中,徐瑞华教授团队基于JUPITER-06研究的基因测序数据,建立了以基因组特征为依据的Esophageal cancer Genome-based Immuno-oncology Classification (EGIC)分型,拓宽了晚期食管鳞癌(ESCC)一线“PD-1抗体+化疗”模式的生物标志物探索方向,为晚期食管鳞癌提供了新的免疫治疗决策手段。

全球食管癌年新发60.41万例,年死亡54.41万例,是危害人类健康的重大疾病之一。食管癌主要包括食管腺癌(EAC)和食管鳞癌(ESCC),其中食管鳞癌最为常见,占全球食管癌的85%。长期以来,对于晚期食管鳞癌的治疗以单纯化疗方案为主,但患者生存获益有限,预后不佳。近年来,多项大型3期随机对照研究(KEYNOTE-590、CheckMate 648、ESCORT-1st、JUPITER-06、ORIENT-15、RATIONALE-306、ASTRUM-007)证实了“PD-1抗体+化疗”模式用于晚期食管癌一线治疗的疗效。其中,JUPITER-06研究数据显示,相比于单纯化疗,特瑞普利单抗(PD-1抗体)联合化疗(紫杉醇+顺铂)一线治疗晚期食管鳞癌患者可以显著改善其无进展生存期(PFS)和总生存期(OS),降低死亡风险达42%。基于这一突破性成果,特瑞普利单抗联合紫杉醇及顺铂的方案已成为晚期ESCC的一线标准治疗方案。
然而,KEYNOTE-590、CheckMate-648研究结果显示,PD-L1低表达患者接受PD-1单抗联合化疗未显示出显著优于单纯化疗的临床获益。为此,徐瑞华教授团队前期对JUPITER-06研究开展了基于PD-L1表达水平的亚组分析,结果显示PD-L1高表达和低表达的患者在化疗基础上联合PD-1抗体治疗均能显著获益。此外,研究团队对相同领域的五项3期临床试验进行了荟萃分析,进一步验证了这一结论。这一研究成果表明:在“PD-1抗体+化疗”的治疗模式下,PD-L1表达水平作为疗效标志物的应用价值有限,亟需寻求更为可靠的疗效标志物。
面对此困境,徐瑞华教授团队基于JUPITER-06临床队列开展了前瞻性临床转化研究,对研究中486名食管鳞癌患者的治疗前肿瘤组织进行了全外显子测序,探索“PD-1抗体+化疗”模式下的疗效标志物及精准治疗策略。
研究团队首先发现,通过表征免疫原性预测免疫治疗疗效的肿瘤突变负荷(TMB)和仅考虑克隆性突变的clonal TMB均无法有效预测在食管鳞癌化疗联合PD-1抗体的疗效,这可能与其表征肿瘤免疫原性的准确度不足有关。既往研究发现,拷贝数变异和突变事件发生的先后关系会影响变异肽段和野生型肽段表达的相对丰度,从而影响突变的免疫原性。研究团队首先根据克隆性突变发生区域的拷贝数变异(CNA)情况对其做出分类,并根据推断的CNA和突变发生的先后关系,进一步将发生在扩增区域的突变区分为CNA-early突变和CNA-late突变;将CNA-late突变排除并对剩余的突变数量进行求和,定义为拷贝数变异校正的TMB(CNA-corrected TMB, ccTMB)。结果显示,具有高ccTMB的患者从化疗联合PD-1抗体中的获益显著优于低ccTMB的患者,在国际上首次证实了优化的免疫原性指标在“PD-1抗体+化疗”模式下可作为可靠的疗效标志物。
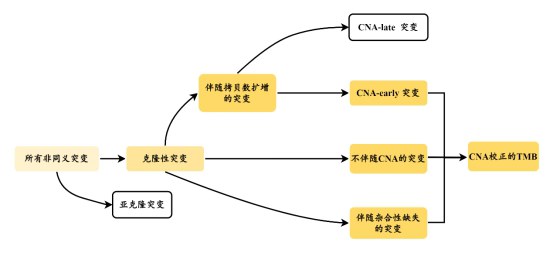
拷贝数变异校正TMB的构建流程
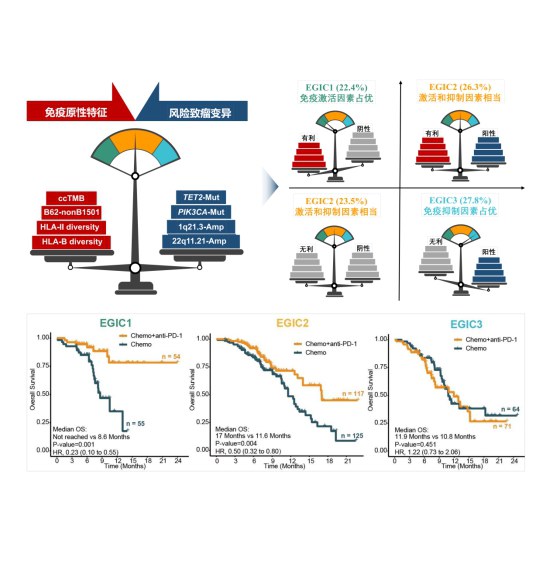
由于人类白细胞抗原(HLA)分子对于抗原的呈递效率同样影响肿瘤细胞的免疫原性,研究团队同时分析了HLA基因型和化疗联合PD-1抗体获益的关系,并且发现HLA-B和HLA-II的多样性、以及非HLA-B1501的HLA-B62超型是化疗联合PD-1抗体的正性疗效预测标志物,联合ccTMB可以进一步构成优化的免疫原性指标,提高预测效能。部分基因组致瘤变异已被证实与PD-1抗体单药耐药相关。研究团队通过对显著突变基因和显著发生拷贝数变异的筛选,发现TET2突变,PIK3CA突变,染色体1q21.3区段扩增和染色体22q11.21区段扩增与ESCC患者对化疗联合PD-1抗体耐药相关。
免疫原性和风险致瘤变异是肿瘤基因组影响免疫治疗获益的两方面因素。为此,研究团队进一步将上述鉴定的免疫原性指标和风险致瘤变异进行了整合,构建了EGIC分型,将免疫原性有利于联合治疗且风险致瘤变异阴性的患者定义为EGIC1型,75%以上的该型患者在化疗联合PD-1抗体治疗中获得持续性获益,且生存曲线的拖尾效应明显;将免疫原性有利于联合治疗或风险致瘤变异阴性的患者定义为EGIC2型,该型患者在该联合模式中也有一定的获益;将免疫原性不利于联合治疗或风险致瘤变异阳性的患者定义为EGIC3型,该型患者无法在化疗联合PD-1抗体中取得获益。对于EGIC3型患者,通过联合靶向干预所携带的风险致瘤变异分子事件可能是进一步提高ESCC患者治疗获益的可行策略。
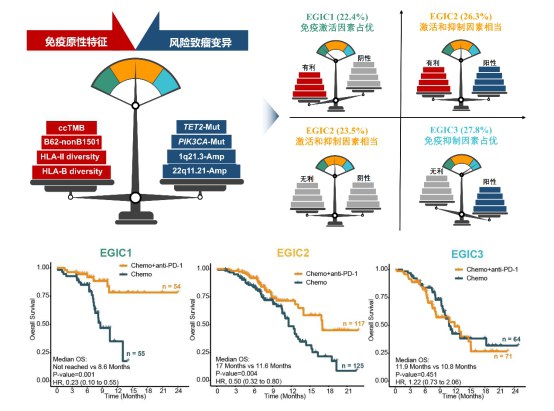
EGIC分型的构建(上)以及不同EGIC分型的患者在PD-1抗体联合化疗中的治疗获益(下)
综上,作为首个面向“PD-1抗体+化疗”治疗模式下晚期食管鳞癌免疫治疗的基因组生物标志物探索,该转化研究通过对免疫原性指标的优化和对耐药相关的致瘤变异事件的系统性鉴定及多维度整合,构建了可以精准预测化疗背景下PD-1抗体治疗获益的EGIC分型,促进了晚期ESCC免疫治疗的个体化决策。同时,EGIC分型为进一步探索更有效的晚期ESCC免疫-靶向联合治疗策略提供了新方向,具有可观的转化前景。
该研究获得了国家自然科学基金、中国医学科学院医学科学与健康科技创新工程、广东省科技计划、广州市科技计划等项目的资助。中山大学肿瘤防治中心徐瑞华教授、王峰教授为该论文的共同通讯作者;陈衍行博士研究生、王梓贤副主任医师、金颖副主任医师、赵齐副研究员为共同第一作者。(通讯员:文朝阳、陈鋆、赵现廷)

