疫苗作为目前唯一的预防性药品,一直以来受到各界关注,全球疫苗市场在刚性需求下得以长期稳定增长。根据Evaluate Pharma数据显示,2018年全球疫苗市场规模达到276.82亿美元。多家药企加入疫苗行业,市场规模有望进一步扩大。
在高门槛、高投入、高利润、严监管的特点下,疫苗行业正处于寡头垄断的竞争格局,多年来全球疫苗销量前十中约一半左右来自四大巨头。我国疫苗产业发展在全球范围内相对落后,提升空间相对突出。受行业危机事件多发和新政策颁布的双重影响,根据弘则研究对我国3家重点疫苗上市公司的业绩对比可知,2014年-2019年智飞生物、康泰生物和沃森生物的营收利润均快速增长,国内疫苗市场前景广阔。
加速推进新冠疫苗研发进程
2020年以来,全球多地的新冠疫情防控形势严峻,部分地区持续恶化。截至12月16日9时,国内累计确诊新冠肺炎病例数95279例,海外累计确诊病例超过2054万例、累计死亡病例数破163万例,其中美国新冠肺炎病例总数超过1714万例。根据世界卫生组织(WHO)的意见,全球约70%人口接种新冠病毒疫苗,也就是说全球或需百亿剂新冠疫苗才能完全阻断新冠疫情蔓延,结束本次大流行。
按照传统经验,研发疫苗需耗时数年,经历临床前研究、临床I期/II期/III期试验和上市几个阶段。新冠疫苗作为全球创新产品,研发呈现出前所未有的态势。复星医药全球研发总裁兼首席医学官回爱民博士在COVID-19疫苗/抗体研发与产业化论坛上透露,新冠疫苗有望将研发时间从传统疫苗的十年缩短为一年。在快速审批和多方合作的特殊研发模式下,根据WHO统计数据,截至11月12日,全球已有48款新冠疫苗进入临床研发阶段,另有164款处于临床前研发阶段。数据显示,全球目前共有13款新冠疫苗进入III期临床试验。
国外药企争分夺秒抢占新冠疫苗赛道,预计明年年初将迎来新冠疫苗密集上市潮。12月2日,辉瑞和拜恩泰科(BioNTech)的新冠疫苗BNT162b2获得世界上第一个抗击COVID-19的疫苗授权,在英国获批紧急使用。此前他们的疫苗显示出超过90%的保护效率。另一款由莫德纳(Moderna)研发的新冠疫苗在第三期临床试验中的保护率达到94.5%,美国食品药品监督管理局(FDA)已在12月15日发布的文件中认可该疫苗的安全性和有效性,有望继辉瑞/ BioNTech的新冠疫苗之后,在本周内获得FDA的紧急使用授权。除英国、俄罗斯和美国率先启动接种工作外,法国、德国、罗马尼亚等国也于近日公布了本国新冠疫苗接种计划。
我国疫苗市场迎来新突破
国内疫苗企业正迎来快速实现技术升级的空前良机。10月8日,中国同全球疫苗免疫联盟签署协议,正式加入"新冠肺炎疫苗实施计划"(COVAX)。该计划预计于2021年底前提供20亿剂新冠疫苗,旨在确保所有国家都能同时获得新冠疫苗,并优先提供给卫生工作者和老年人等高风险人群。截至目前,我国已有5款新冠疫苗进入III期临床试验,分别由国药集团(其中2款)、科兴中维、智飞龙科马、康希诺生物与陈薇院士团队合作研发。
早前,国药集团正式向国家药监局提交了新冠疫苗上市申请,并启动新冠疫苗全国物流演练。该集团中国生物北京生物制品研究所研发的新冠灭活疫苗于12月9日在阿联酋获批上市,数据显示有效率达86%。未来,中国疫苗作为全球公共产品,还将可能通过援助等方式来实现部分发展中国家或不发达国家新冠疫苗的可及性和可负担性。
此外,受新冠肺炎疫情影响,大众健康和接种意识大幅提升,我国今年秋季流感疫苗需求旺盛。根据莫尼塔数据显示,截至8月20日,今年流感疫苗共计批签发1415.56万支,同比增长52%,但上海、天津、重庆、浙江、广西等地均出现"一苗难求"的情况。
新政策规范疫苗市场
在《中华人民共和国疫苗管理法》(下称《疫苗管理法》)颁布之前,我国拟定了多项监管政策,涉及研发、生产、审批、流通、监督检查、异常反应处理6大环节,具体政策如下表所示。
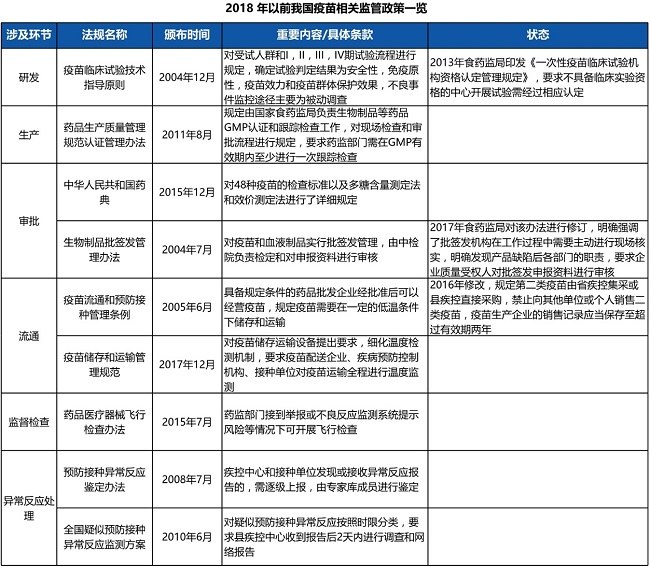
(资料来源 :国家食药监局官网/中国卫生部官网/观研天下/中银国际证券 制表:39健康·医药好文工作室)
2019年12月1日,全球首部疫苗相关的法律--《疫苗管理法》正式施行。该法对于生产企业的规模、质控、技术工艺提出更高的要求,拓宽了疫苗企业在生产、销售、流通领域的护城河,也明确规定当出现特别重大公共卫生事件,由国家卫生健康委提出紧急使用疫苗的申请,由国家药监局组织专家论证并同意,由国家卫生健康委在一定范围、一定时限内紧急使用疫苗。因此,受新冠疫情影响,目前我国正式开始紧急使用新冠疫苗,比如上海已对一线接触进口货物处理的员工提供免费自愿疫苗紧急接种。
此外,11月19日,国家药品监督管理局药品审评中心(CDE)官网发布了关于《药品附条件批准上市技术指导原则(试行)》的通告,即时施行。根据该指导原则,药物临床试验期间,符合两种特定情形的药品,可以申请附条件批准。该新政策的发布将有利于加速我国疫苗产品的上市。
国内疫苗企业起步晚,潜力大
相比于全球市场,中国疫苗行业起步较晚,国内企业与疫苗四大巨头在市场格局、技术产品等方面虽有较大差距,但充满潜力。
根据中银国际证券显示,辉瑞作为全球疫苗市场的巨头之一,2018年公司整体收入中12%来自疫苗业务,其中最核心的疫苗品类为沛儿系列(主要是PCV13)。被称为"新冠疫苗第一股"的康希诺生物,建立了针对13个疾病领域的16种创新疫苗产品的研发管线,涵盖了对新型冠状病毒肺炎、埃博拉病毒病、结核病等一系列疾病的预防。复星医药常见的疫苗产品则为甲型H1N1流感病毒裂解疫苗和流行性感冒病毒裂解疫苗。面对新冠疫情,中美三大药企快速加入开发和试验行列,最新进展如下表所示。

(资料来源:界面新闻/第一财经/凤凰卫视 制表:39健康·医药好文工作室)
39健康·医药好文工作室对比分析这三家企业2016年至2020年三季度的营收情况,以及研发费用占总成本的比重发现,2020年三季度幅度与往年无明显差异,尽管辉瑞和康希诺生物都更注重研发(研发经费占总成本60%以上),但两者间的利润差距相对明显,康希诺生物尚未完全实现盈利。复星医药的研发成本虽不足10%,但一直处于缓慢上升的状态。
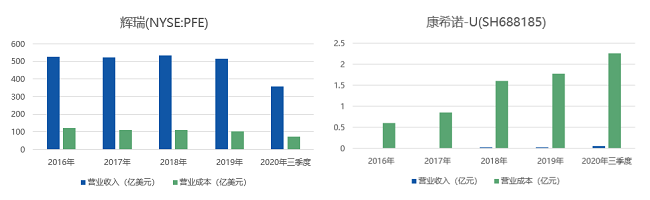
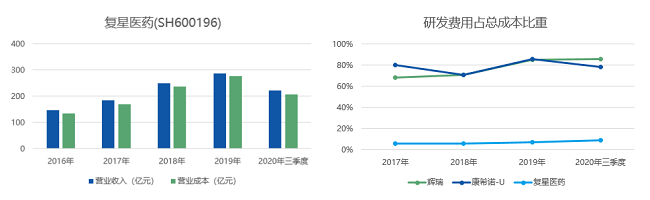
(数据来源:雪球网 制表:39健康·医药好文工作室)

