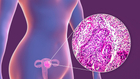
尽管遭到FDA专家委员拒绝,但FDA还是毫不犹豫的加速批准了阿斯利康的卵巢癌药物Lynparza(olaparib)。该药的获批,也标志着阿斯利康管线中新增了一枚重磅产品。就在前一天,Lynparza也获得了欧盟的批准。
具体而言,FDA已批准Lynparza用于既往经至少3次化疗治疗失败的BRCA胚系突变晚期卵巢癌患者的治疗。Lynparza(olaparib)是一种首创口服多聚ADP核糖聚合酶(PARP)抑制剂,利用DNA修复途径的缺陷,优先杀死癌细胞。目前,阿斯利康正开展多个III期研究,调查olaparib用于BRCA突变卵巢癌、胃癌、乳腺癌的治疗。
Lynparza通过FDA的加速审批程序批准,该药的获批是基于一项单组开放标签II期研究的数据及其他研究的安全性数据。该II期研究在137例既往经至少3次化疗失败的BRAC胚系突变晚期卵巢癌患者中开展,数据表明,olaparib维持疗法取得了34%的总缓解率(ORR),中位缓解持续时间为7.9个月。此前的一项研究表明,与安慰剂相比,olaparib显著延长了无进展生存期(PFS:11.2个月 vs 4.3个月,p<0.00001)。
今年2月,阿斯利康根据一项II期临床数据向FDA提交了olaparib的监管文件,该研究评估了olaparib治疗铂类敏感性复发性高度浆液性卵巢癌的治疗。今年6月,FDA肿瘤药物顾问委员会(ODAC)以11:2的投票结果拒绝加速批准olaparib,并建议FDA等待阿斯利康正在开展的III期临床研究结果。今年7月,应FDA要求,阿斯利康提交了一份关于olaparib新药申请的重大修订,提供了额外数据支持了olaparib用于既往经至少3次化疗治疗失败的BRCA胚系突变卵巢癌患者的治疗。
目前,阿斯利康正在开展III期SOLO临床项目,FDA将对该项目的2个III期研究SOLO-2和SOLO-3进行全面审查,届时再决定是否将olaparib加速批准转为完全批准。SOLO-2研究正在调查olaparib作为一种维持疗法相对于安慰剂的疗效;SOLO-3研究正在调查治疗复发性卵巢癌时olaparib相对于标准化疗的疗效。SOLO-2研究的数据预计将在2015年获得,SOLO-3研究数据预计将在2019年获得。
今年早些时候,在拒绝辉瑞1140亿美元收购时,阿斯利康向投资者描绘了其肿瘤学管线的美好前景。阿斯利康对olaparib寄予厚望,认为该药的年销售额将突破20亿美元。不过,阿斯利康对肿瘤免疫疗法PD-L1抑制剂MEDI4736和另一种抗癌药AZD9291的期望更高,预测2者的年销售峰值分别为65亿美元和30亿美元,后者目前正处于I期临床。然而,这些产品要想实现预期目标,将取决于在一系列癌症中的临床成功。
另外,卵巢癌领域,FDA今年11月批准罗氏安维汀(Avastin)用于复发性卵巢癌。生物技术巨头安进研发的一款卵巢癌药物AMG-386已处于III期阶段。





 刘泽群
刘泽群
 万万没想到,“神药”二甲双胍会在这“小病”遇滑铁卢?2021-11-09
万万没想到,“神药”二甲双胍会在这“小病”遇滑铁卢?2021-11-09 这4类药,儿童不宜服用!记下来千万别中招2021-10-14
这4类药,儿童不宜服用!记下来千万别中招2021-10-14 国庆小长假想放飞自我?这5个用药规则千万别忘记!2021-09-30
国庆小长假想放飞自我?这5个用药规则千万别忘记!2021-09-30 疾病负担日益加重 新药研发失败率高 AD如何与寿命“赛跑”?2021-09-24
疾病负担日益加重 新药研发失败率高 AD如何与寿命“赛跑”?2021-09-24 长期服用阿片类药物患者换为丁丙诺啡,风险有多大?2021-09-10
长期服用阿片类药物患者换为丁丙诺啡,风险有多大?2021-09-10 阳泉哪家医院治甲状腺功能减退好2025-04-01
阳泉哪家医院治甲状腺功能减退好2025-04-01 清远治男性不育正规医院推荐2025-04-01
清远治男性不育正规医院推荐2025-04-01 遂宁哪家医院治淋病权威2025-04-01
遂宁哪家医院治淋病权威2025-04-01 茂名哪家医院治青光眼2025-04-01
茂名哪家医院治青光眼2025-04-01 南阳哪家医院治面部整形比较好2025-04-01
南阳哪家医院治面部整形比较好2025-04-01
