免疫系统与肿瘤免疫治疗
Part1:肺的免疫系统如何消除空气中病原体?
肺是人体的呼吸器官,我们的每一次呼吸,都离不开肺的作用。
肺的支气管经过多次反复分枝,形成无数的细支气管,这些很细小的支气管的末端膨大成囊,囊的四周有很多的小泡,这就是肺泡。成人肺泡的总面积,全部展开相当于一个网球场的大小。
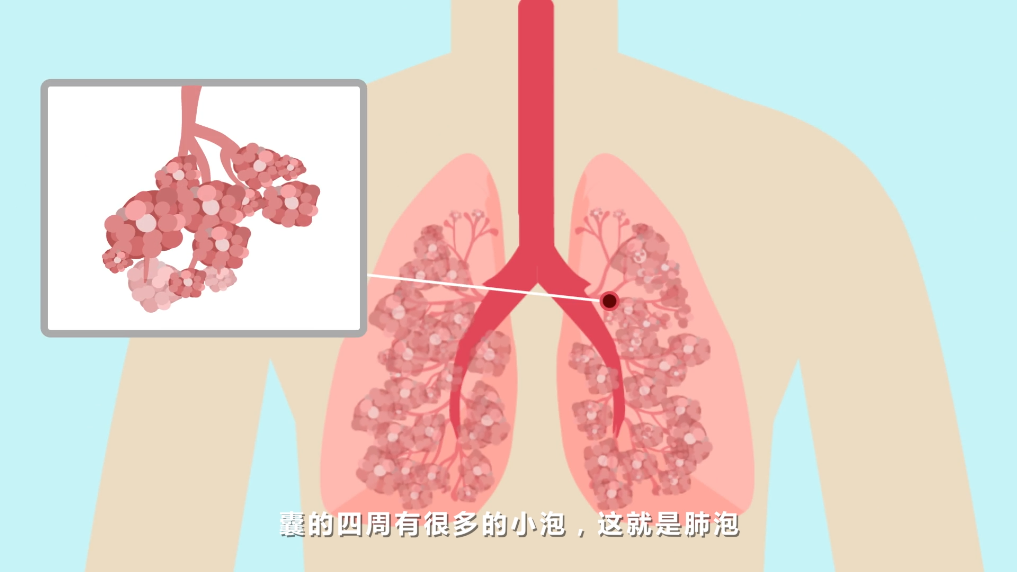
在肺呼吸的过程中,气流需要经过专门的通道,这一通道被称为呼吸道。在我们的呼吸过程中,上呼吸道的表面都会直接暴露于病毒、细菌、霉菌等病原体,以及空气中存在的各种微粒。
为了抵御这些有害颗粒,肺采用了物理、免疫两道防御体系来保护自己。

其中最常见的防御体系是物理防御,如咳嗽,气道产生的粘液,既可以防御病原体的侵袭,又可以通过纤毛上皮的运动清除有害颗粒。
然而还是有少数的病原体可以突破物理防御,悄悄进入肺泡内部。
那么,就需要启动免疫防御来清除这些进入肺泡内部的有害颗粒。
气道内有数以百万计的吞噬细胞和淋巴细胞(T细胞)。

这些免疫细胞通过与外来的病原体(抗原)的结合来激活一种特殊的炎症反应,并将T细胞聚集到肺部。
T细胞负责识别异常的细胞,直接杀死已被病原体感染的细胞。而吞噬细胞负责吞噬、消化突破物理防御的病原体。


T细胞是非常重要的免疫细胞,就像警察一样,专门负责消除病原体。一部分T细胞也可以将它们记录在案,保证下次病原体再次入侵时,可以快速有效的将其消灭。
T细胞在肺部时刻保持着活性,并随时准备抵御病原体的入侵。
免疫细胞能不能在清除外来病原体的同时,监视内部的坏分子——肿瘤细胞的生长?
当然可以!吞噬细胞和T细胞可以清除肿瘤细胞,如果肿瘤组织中出现这些免疫细胞,说明肿瘤得到了初步的控制,患者将很快得到好转。
Part2:为什么还有肿瘤细胞可以逃避肺部的免疫系统的监视,发展成癌症?
肿瘤细胞的免疫逃逸机制多样。

Part3:肿瘤细胞是如何逃避免疫监视的?
例如降低特征性标记物的表达,让免疫系统无法识别。

不仅如此,肿瘤细胞还有其他多种手段对付免疫卫士,包括通过微环境,影响免疫卫士的识别能力,让免疫卫士无法有效杀死肿瘤细胞。
此外,肿瘤细胞还会趁机瞄准T细胞,触发T细胞的凋亡。
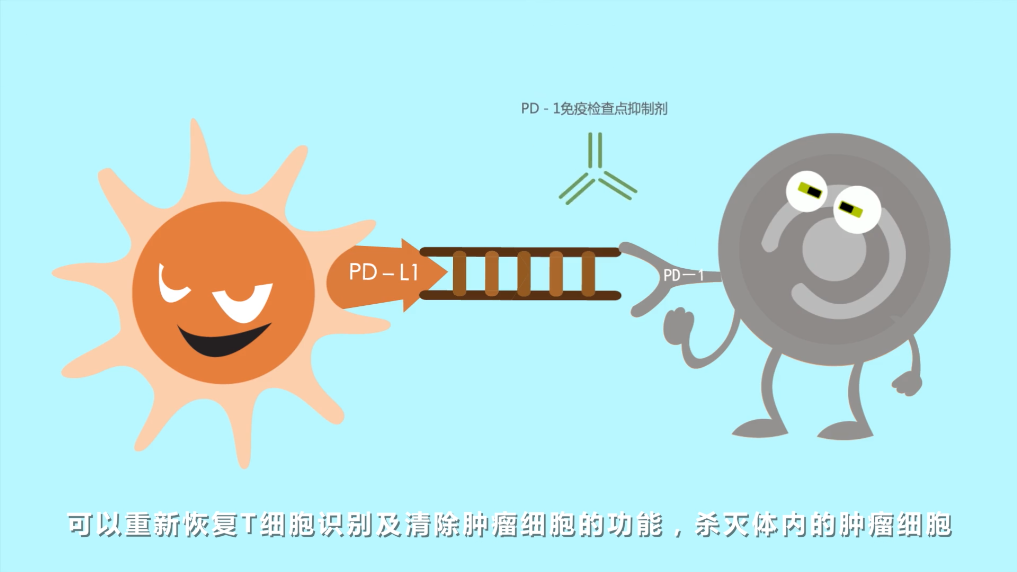
肿瘤细胞可通过激活免疫检查点,使得T细胞的免疫功能受到限制,无法发挥其应有的杀灭肿瘤细胞的作用,从而悄悄的逃离T细胞的追杀。

Part4:肺癌的免疫治疗可以为更多患者带来新希望
科学家们研发了抑制免疫逃逸的关键性药物,PD-1免疫检查点抑制剂,可以重新恢复T细胞识别及清除肿瘤细胞的功能,杀灭体内的肿瘤细胞。
肺癌的免疫治疗可以为更多患者带来生存获益。
NP/NIV/3219/04/25/18-04/24/19
参考文献:
1. US EN Fact Sheet Understanding I-O in Metastatic Non-Small Cell Lung Cancer
2. Nicod LP. Lung defences: an overview. Eur Respir Rev. 2005;14:45-50.
3. Curtis JL. Cell-mediated adaptive immune defense of the lungs.
Proc Am Thorac Soc. 2005;2: 412-416.
4. Martin TR and Charles WF. Innate immunity in the lungs. Proc Am Thorac Soc. 2005; 2403-411.
5. 现代细胞与分子免疫学, 林学颜,北京:科学出版社.
6. Schreiber RD, et al. Cancer immunoediting: integrating immunity's roles in cancer suppression and promotion. Science. 2011;331:1565-1570.
7. Toepfer K, et al. Tumor evasion from T cell surveillance. J Biomed Biotechnol. 2011; 2011:918471.
8. Kawai O, et al. Predominant infiltration of macrophages and CD8(+) T Cells in cancer nests is a significant predictor of survival in stage IV nonsmall cell lung cancer. Cancer. 2008;113:1387-1395.
9. Zhuang X, Xia X, Wang C, Gao F, Shan N, Zhang L. A high number of CD8+ T cells infiltrated in NSCLC tissues is associated with a favorable prognosis. Appl Immunohistochem Mol Morphol. 2010; 18: 24-28.
10. Niehans GA, et al. Human lung carcinomas express Fas ligand. Cancer Res. 1997 ;57: 1007-1012.
11. Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12: 252-264.
12. Chen C, et al. Induced expression of B7-H3 on the lung cancer cells and macrophages suppresses T-cell mediating anti-tumor immune response. Exp
Cell Res. 2013; 319: 96-102.
13. Li ZY, et al. Clinical significance of B7-H4 expression in matched non-small cell lung cancer brain metastases and primary tumors. Onco Targets Ther. 2013; 6: 869-875.
14. Muenst S, et al. The PD-1/PD-L1 pathway: biological background and clinical relevance of an emerging treatment target in immunotherapy. Expert Opin. Ther. Targets. 2015; 19(2):201-211.
15. Nivolumab说明书(FDA批准版本)
16. Brahmer J, et al. Nivolumab versus Docetaxel in Advanced Squamous-Cell Non–Small-Cell Lung Cancer. N Engl J Med. 2015;373(2)123-35.
17. Borghaei H, et al. Nivolumab versus Docetaxel in Advanced Nonsquamous Non–Small-Cell Lung Cancer. N Engl J Med. 2015;373(17)1627-39
18. Horn L, et al. Nivolumab Versus Docetaxel in Previously Treated Patients
With Advanced Non–Small-Cell Lung Cancer: Two-Year Outcomes From Two Randomized, Open-Label, Phase III Trials (CheckMate 017 and CheckMate 057). J Clin Oncol. 2017;35(35)924-3933.
19. Reck M,et al. Impact of Nivolumab versus Docetaxel on Health-Related Quality of Life and Symptoms in Patients with Advanced Squamous Non–Small Cell Lung Cancer: Results from the CheckMate 017 Study. J Thorac Oncol. 2018; 13(2): 194-204.

↑点击去参与测试 拜拜粗腰肥大腿↑
 肿瘤免疫治疗相关不良反应处理宝典
肿瘤免疫治疗相关不良反应处理宝典
肿瘤免疫治疗相关不良反应,毒副作用(irAE)发生率低、多为轻中度,肿瘤免疫治疗和化疗药物,靶向药物的作用机制不同,治疗相关毒副作用存在差异...…【详细】

